
כנס זכויות חולים

























































רוב המקרים של CML מתרחשים במבוגרים. כ-2 אחוזים מכלל המקרים של CML קורים בילדים, מתבגרים ומבוגרים צעירים מתחת לגיל 20.
הטיפול בילדים עם CML אינו סטנדרטי. לעתים קרובות הוא עוקב אחר הנחיות שפותחו למבוגרים, למרות שיש הבדלים בין CML בילדים למבוגרים מבחינת הצגת המחלה והתקדמות. כמה מחקרים מצביעים על כך שלילדים ולמטופלים צעירים יש שיעורים נמוכים יותר של תגובות ציטוגנטיות מלאות ותגובות מולקולריות עמוקות בהשוואה למבוגרים יותר. ילדים ומבוגרים צעירים עשויים להיות בעלי סיכון מעט גבוה יותר למעבר לשלב מואץ ובלסטי.
ילדים עם CML מטופלים ע"י המטולוג-אונקולוג ילדים אשר מומחה בטיפול בילדים חולים בסרטן הדם, בדגש על סוגי סרטן המאפיינים ילדים.
המטו-אונקולוג ילדים פוגש מעט מאוד ילדים חולי CML ולא מכיר לעומק את מגוון הטיפולים והחידושים בטיפול ב-CML.
מומלץ שההורים יבקשו לפגוש המטו-אונקולוג מבוגרים שמתמחה ב-CML וזה לא פשוט.
הנושא החשוב ביותר בתקופה הראשונה הוא מעקב אחרי ה-PCR ולוודא שיורד בקצב המומלץ.
תרופות ה-TKI הבאות מאושרות לטיפול ב-CML בילדים:
מאחר שילדים עם CML עשויים לקבל טיפול ב-TKI למשך הרבה יותר זמן מאשר מבוגרים ובתקופות של צמיחה פעילה, טיפול מעקב חשוב מאוד. בנוסף לבדיקת התגובות של הילדים לטיפול, על הרופאים גם לפקח על תגובות ילדים
הצמדות לקויה לטיפול, במיוחד בקרב מתבגרים ומבוגרים צעירים, היא דאגה נוספת. עם תרופות TKI פומיות, חשוב לעקוב אחר הוראות הרופא ולהמשיך לקחת את התרופה כל עוד נקבע. ידוע כי אי היצמדות לטיפול ב-TKI מגבירה את הסיכון לתגובה נמוכה יותר או אולי לכישלון טיפול.
בהתחשב בחששות הפוטנציאליים של טיפול TKI לכל החיים, המומחים חוקרים הפסקת טיפול ב- TKIs לאחר תקופה של מספר שנים עם תגובה מולקולרית עמוקה. הפוגה ללא טיפול נחשבת כיום למטרה של טיפול בחולים נבחרים ומהווה מוקד מחקר בניסויים קליניים מתמשכים שונים.
השתלת תאי אב אלוגניים היא אפשרות טיפול נוספת. מכיוון שלא היו ניסויים מבוקרים אקראיים שהשוו השתלת תאי גזע ואימטיניב בילדים עקב המספר הקטן של מטופלים בילדים, ההחלטה כיצד לטפל ב-CML התקבלה באופן אינדיבידואלי. יש להעריך השתלת תאי אב מול הסיבוכים הקשורים לשימוש ב-TKI לכל החיים.
שוחח עם הרופא של ילדך על הטיפול הטוב ביותר עבור ילדך ודון בכל דאגה בנוגע לסיכונים הקשורים לטיפול בילדך.
תפקיד העמותה משמעותי מאוד למשפחות עם ילד חולה CML, בגלל שהמחלה נדירה בילדים, והעמותה יכולה לחבר בין הורים לילדים עם CML. מומלץ להגיע לכנסים ולמפגשים , גם אם מגיעים בלי הילדים.
השפעה על אספקטים נוספים בחיים:
גיוס לצה״ל→ כאמור לרוב המחלה היא מחלה כרונית לכל דבר וניתן לקיים איתה אורח חיים תקין ומלא. קיימים תקדימים של צעירים החולים ב- CML אשר גויסו לצה״ל, מדובר בהתנדבות וחשוב לדעת שהדבר אפשרי, זה כמובן תלוי רצון והמצב הבריאותי האישי של החולה.
מחלות ורופאים שונים– חשוב לזכור שהרבה רופאים בתחומים אחרים לא מכירים לעומק CML ובמיוחד CML אצל ילדים ונוער, ומשמעויות הטיפול בו. לכן יש חשיבות גדולה להיכרות אישית עם המחלה, קורה לא מעט שאנחנו מלמדים רופאים אחרים (שאינם המוטו-אונקולוגים, למשל רופא משפחה, רופא עור וכו׳) על הטיפול שלנו. ברוב המקרים לרופאים האחרים יש נטייה להילחץ כי מדובר בילד חולה בלוקמיה, אך יש להדגיש שמדובר בלוקמיה מילואידית כרונית, וההשלכות של זה עשויות להיות אחרות, למשל כמו העובדה שהמערכת החיסונית אינה מוחלשת וכו׳. באותה המידה זה גם יכול להיות הפוך, התרופות הינן יחסית חדשות בעולם ואין מחקרים רבים על ילדים, אז תמיד יהיה ספק האם הדבר קשור במחלה או בטיפול בה או שאינו תלוי בה, ככל הנראה לא תהיה תשובה חד משמעית.
זכויות → ילדים עם CML לא זכאים לאחוזי נכות בביטוח לאומי אם אין פגיעה קשה בתפקודם.
לצפייה בראיון עם גל שחלתה ב- CML בגיל 14 ואמה תמי- לחץ כאן
פרופ' פיה רענני, מנהלת המערך להמטולוגיה ולהמטו-אונקולוגיה, מרכז רפואי רבין.
מעודכן לשנת 2021
מי היה החוקר הראשון שתיאר את המחלה לויקמיה מיילואידית כרונית (CML)? הדעות חלוקות.
יש הטוענים כי זה היה הפתולוג הגרמני רודולף וירכוב, ואילו אחרים סבורים כי הראשון היה עמיתו הסקוטי, ג'ון יוז בנט. כך או כך, שניהם דיווחו על המחלה עוד באמצע המאה ה-19, אך רק בעשור האחרון חלה התקדמות רבה ביכולת לרפא את המחלה.
ההתקדמות היא בעיקר הודות לטיפולים ממוקדים שפותחו, שהם, במידה רבה, תולדה של פריצת דרך משמעותית בהבנת המחלה וביכולת לאבחן אותה, שהתרחשה לפני 50 שנה בפילדלפיה. במכתב קצר שפירסמו אז בכתב העת "Science", תיארו שני מדענים שעבדו בשני מוסדות מחקר בעיר, פיטר נואל ודייוויד הנגרפורד, הפרעה כרומוזומלית האופיינית למחלה.
לפי המכתב, בדמם של חולי לויקמיה מיילואידית כרונית ובמוח העצם שלהם יש כרומוזום 22 קצר מהרגיל. הכרומוזום הקצר, ששני החוקרים כינו כרומוזום פילדלפיה, נמצא אך ורק אצל החולים במחלה זאת (כיום אנו יודעים כי הוא מצוי גם בסוג מסויים של לויקמיה חריפה). הם אף העלו את ההשערה כי קיים קשר נסיבתי בין כרומוזום פילדלפיה לבין התפתחות המחלה. אבל חלפו עוד כ-40 שנה עד שמדענים הצליחו ליישם את ההבנה שטיפול בכרומוזום זה עשוי להביא לחיסול המחלה.
בזמן האבחנה חלק מהחולים אמנם מדווחים על חולשה, עייפות ותחושה של מלאות בבטן, אבל כמחציתם אינם מדווחים על תסמינים. אצל חולים אלה, המחלה מתגלה באופן אקראי. בבדיקת דם מתברר, בדרך כלל, שאצל החולים רמת כדוריות הדם הלבנות גבוהה (לויקוציטוזיס) ורמת ההמוגלובין נמוכה (אנמיה).
המהלך הקליני של המחלה נחלק לשלושה שלבים: שלב כרוני, שלב מואץ ומעבר ללויקמיה חריפה, שהיא מחלה קשה וסוערת. בעבר, תוחלת החיים הממוצעת בשלב הכרוני, ללא טיפול, היתה חמש-שש שנים. בשלבים המתקדמים תוחלת החיים היתה חודשים ספורים.
כרומוזום פילדלפיה נושא גן משולב (כימרה) המכונה BCR-ABL1. גן זה מעורב בייצור חלבון משרה סרטן (אונקוגני), המכונה bcr-abl1, שדומה בפעילותו לאנזים טירוזין קינאז. פעילותו של האנזים גורמת שינויים בתהליכים המתרחשים בתא, כולל עידוד התרבות והתמיינות, ועיכוב של מוות תאי מתוכנת. כתוצאה מכך משיגים תאי מוח עצם הנושאים את הגן BCR-ABL1, יתרון הישרדותי על פני תאי אב אחרים, ולבסוף הם שולטים במוח העצם. הגן BCR-ABL1 שייך למשפחת הגנים מחוללי הסרטן, ופגיעה בו או בחלבון האונקוגני שהוא מייצר, עשויה לאפשר השגת שליטה במחלה ואפילו את חיסולה.
עד לגילוי של נואל והנגרפורד, דישדש הטיפול. החולים קיבלו כימותרפיה, הקרנות לטחול, זריקות אינטרפרון או השתלת מוח עצם. חלק מהטיפולים היו לא יעילים והיו כרוכים בסבל רב. את פריצת הדרך המשמעותית בטיפול במחלה חולל לפני כ- 2 עשורים החוקר בריאן דרוקר מאורגון שבארצות הברית. הוא פיתח את התרופה אימטיניב, שהיא אב-טיפוס למגמה החדשה בטיפול בסרטן בכלל ובסרטן הדם בפרט. פעילותה של התרופה, שפותחה מתוך הבנה של הגן והחלבון הגורמים למחלה, מבוססת על עיכוב של החלבון bcr-abl1 טירוזין קינאז. לכן מכונה האימטיניב מעכב טירוזין קינאז מהדור הראשון.
התרופה ניתנת באמצעות כדורים, גורמת תופעות לוואי לא מסוכנות בדרך כלל ותוצאות הטיפול בה מצוינות. ספירת הדם של החולים הופכת לתקינה לחלוטין; כרומוזום פילדלפיה נעלם מגופם לחלוטין; כמות הגן הכימרי בדמם יורדת כמעט לרמות אפסיות. עם זאת, הגן לא נעלם לחלוטין ואם מפסיקים את הטיפול רמתו שבה ועולה. שיעור החולים שמחלתם עוברת לשלבים המואצים יורד משמעותית, שיעורי ההישרדות שלהם גבוהים ורבים מהם חוזרים לנהל חיים נורמליים כמעט לחלוטין. עקב תכונות אלה, התרופה אימטיניב אושרה על ידי מינהל הבריאות והמזון האמריקאי (FDA) לטיפול בחולי לויקמיה מיילואידית כרונית בהליך מזורז ונכנסה גם לסל הבריאות בישראל בשנת 2002.
עם זאת, בעשורים שחלפו מאז נכנסה התרופה לשימוש נאלצו לזנוח אותה כשליש מהחולים, אם בשל תופעות לוואי כמו בצקות ואגירת נוזלים, פריחות בעור, פגיעה בתפקודי הכבד ועוד ואם מפני שהגן 1 BCR-ABL פיתח עמידות לתרופה. נתונים אלה הביאו לניסיונות מואצים לפיתוח תרופות נוספות שמעכבות את החלבון.
בשנים האחרונות נכנסו לשימוש שתי תרופות חדשניות – דסטיניב ונילוטיניב, אף הן תרופות ממוקדות נגד החלבון האונקוגני, והן מכונות מעכבי טירוזין קינאז מהדור השני. בזכות השימוש בהן, יותר משני שלישים מהחולים שנאלצו להפסיק את הטיפול באימטיניב, השיגו תגובה מצוינת, ללא עדות להתקדמות המחלה. גם תרופות אלה נכנסו לשימוש בארץ ובעולם. כיום, חולה CML בארץ, שאינו מגיב לאימטיניב או מגלה אי-סבילות לתרופה זאת, זכאי לקבל את התכשירים מהדור השני.
בשלב הבא נבדק אם תרופות אלה יעילות יותר מאימטיניב גם כקו טיפול ראשון. השבועון היוקרתי "New England Journal of Medicine" פירסם שני מחקרים גדולים שנערכו בארצות הברית ובאירופה, שבהם נמצא כי בתקופת מעקב של שנה היה לכל אחד מהתכשירים החדשים יתרון על פני אימטיניב מבחינת עומק ומהירות התגובה.
לפי המחקרים, התרופות החדשות יעילות יותר מבחינת ההשפעה על פעילות הגן והחלבון ואף מפחיתות את המעבר לשלבים המואצים. לא נמצא כי לתכשירים מהדור השני יש יתרון מבחינת הארכת תוחלת החיים. אף על פי שהנתונים מבטיחים, הם אינם מספיקים כדי ששתי התרופות יחליפו את האימטיניב כקו הטיפול הראשון באופן גורף בכל החולים וההחלטה אם לבחור בהם או באימטיניב כקו טיפול ראשון עדיין בבדיקה והיא אינדיבידואלית לארצות השונות, למוסד המטפל ולחולה. בארץ מאושרות מספר תרופות מהדור הראשון והשני לטיפול בקו ראשון בחולים.
שתי תרופות חשובות נוספות בטיפול במחלה הן פונטיניב ובוזוטיניב, אף הן ממשפחת מעכבי טירוזין קינאז. פונטיניב ניתנת במקרים של עמידות לתרופות לעיל או במקרה של הופעת מוטציה המקנה עמידות לתאים בפני רוב התרופות ממשפחת הטירוזין קינאז (T315I). התרופה הינה פוטנטית ביותר אך יש להיות מודעים גם לתופעות הלוואי שלה – בעיקר החשש מהופעת אירועים קרדיו-וסקולריים ויש לברור בקפידה את החולים שיטופלו בתרופה. התרופה מאושרת בסל התרופות בארץ למקרים שקיימת המוטציה T315I או במקרים שפיתחו עמידות לתרופות האחרות.
בוזוטיניב היא תרופה בעלת עוצמת פעילות כמו הנילוטיניב והדזטיניב. התרופה אושרה לסל התרופות בשנת 2017 כקו טיפול מתקדם ובהמשך לקו טיפול ראשון.
הודות לחמש התרופות האלה, בעשר השנים האחרונות נהפכה הלויקמיה המיילואידית הכרונית ממחלה סופנית, שהתחזית לחולים בה גרועה, למחלה כרונית המאפשרת אורח חיים כמעט נורמליים לחלוטין. כיום כמעט שאין חולים שמחלתם עוברת מהשלב הכרוני לשלב החריף ויותר מ-90% מאלה שאובחנו בעשור האחרון, נותרו בחיים. בתוך עשר שנים עברנו מהתחבטות בין טיפולים הכרוכים בתופעות לוואי קשות ובאחוזי תמותה לא מעטים, להתלבטות בין כמה טיפולים מצוינים ונגישים, שמהם אפשר לבחור את הטיפול הטוב ביותר.
לאחרונה, נבחנות תרופות נוספות במסגרת מחקרים קליניים וטיפולי חמלה. מדובר בתרופות שאינן משתמשות במנגנון של מעכבי הטירוזין קינאז כמו התרופות המוכרות שהוזכרו לעיל.
החשובה שבהן היא ABL001 שמעכבת את החלבון המסרטן באזורים שונים ממעכבי הטירוזין קינאז הקלסיים ולכן יעילה במקרים שטיפולים אלה נכשלו, שהתפתחו כנגדן תופעות לוואי או בשילוב איתן.
תרופות נוספות – מחקריות בלבד נמצאות בבדיקה ומעכבות את החלבון המסרטן או מסלולים סרטניים שהוא מפעיל בנקודות שונות.
ולסיום, בשנים האחרונות מתפתחת מגמה של הפסקת טיפול במעכבי טירוזין קינאז בחולי CML בפאזה הכרונית בחולים שהשיגו הפוגה מולקולרית עמוקה. הפסקת טיפול דורשת ניטור קפדני וכמחצית מהחולים שהטיפול הופסק אצלם נאלצים לחדש אותו עקב הישנות מחלתם. יש לציין שהפסקת הטיפול במידה ונעשית בתנאים הנכונים ובחולים עם תגובה עמוקה וממושכת לטיפול תוך ניטור קפדני הינה בטוחה.
ניתן לומר כי היום, לחולה חדש שמאובחן עם CML קיים סיכוי של כ-25% להפסקת טיפול ללא הישנות המחלה לאחר פרק זמן של טיפול קפדני.
לסיכום, ממחלה סופנית עם טיפולים קשים ותופעות לוואי בלתי נסבלות הפכה היום CML למחלה כרונית עם מגוון אופציות טיפוליות ובכרבע מהמקרים אף ברת ריפוי.
הכותבת, פרופ' פיה רענני, היא מנהלת המערך להמטולוגיה ולהמטו-אונקולוגיה, מרכז רפואי רבין, עורכת העיתון ההמטולוגי הבינלאומי ACTA HAEMATOLOGICA וראש הוועדה לקרנות מחקר בפקולטה לרפואה על שם סאקלר באוניברסיטת תל אביב.
למדריך לחולי CML ולבני משפחתם, מעודכן לשנת 2020 – עמותת חולי CML, לחץ כאן.
להמלצות טיפול לאנשים החיים עם CML, מעודכן לשנת 2020 – עמותת חולי CML, לחץ כאן.
כמו התחלה של כל סיפור, גם אני חייתי חיים שגרתיים למדי, עבודה מסודרת בארגון ממשלתי, חיים פסטורליים בצפון, אישה שהיא החברה הכי טובה וילד אחד בן 5 שהוא הכל. וכן, יש גם את הספורט. ריצות למרחקים ארוכים תמיד היו חלק משמעותי מחיי ומשגרת יומי. תחושת ההתנתקות במהלך הריצה מילאה אותי יותר מכל דבר אחר, זה רק אתה, היעד שמולך והדרך.
אני גבר בריא, צעיר, חזק וספורטיבי, רק בן 34, ואין שום סיבה שארוץ למיון בגלל בדיקת דם לא ברורה. הרופאה התעקשה ושלחה אותי לבצע סדרה של בדיקות מעבדה אצל רופאה פרטית, לאחריהם היא בישרה לי שאני חולה CML. בשלב הזה, זה עדיין נשמע לי כמו סינית. לא היה לי מושג שמדובר בסוג של סרטן דם וליתר דיוק, לוקימיה מילואידית כרונית. כ-70 אנשים חולים במחלה מדי שנה בישראל, וכנגד כל הסטטיסטיקות והסיכויים, גם אני ביניהם.
אי אפשר להסביר במילים את התחושה המיידית שמציפה את הגוף, כששומעים את המילה סרטן. את התאריך ה-26.4.2011 בו התבשרתי על המחלה כבר לא אוכל לשכוח. השאלה הראשונה שעלתה הייתה – איך אני הולך לבשר למשפחה שלי שהחיים הולכים להשתנות? והשאלה השנייה שעלתה הייתה – האם אני אוכל לרוץ? כמובן שברגע שסיימתי עם הרופאה, יצאתי לריצה.
הטיפולים החלו מיד, ורק כדי להסביר את הקושי: כמו כל מחלות הסרטן, אין תרופה אחת וודאית. את הטיפול הרפואי מקבלים בשלבים, בתקווה שמשהו יתפוס ויהיה מספיק חזק כדי להילחם במחלה. תחילה מטפלים לרוב בעזרת תרופות המיועדות לדכא את המנגנון הסרטני שבתאי הלויקמיה. לא מדובר בכימותרפיה, אך התרופות האלה הן בעלות תופעות לוואי קשות וניתנות בצורת כדורים לבליעה.
כיום קיימות שלוש תרופות ותיקות: האימטיניב מהדור הראשון, נילוטיניב ודסטיניב מהדור השני כשלאחרונה נוספה תרופת האיקלוסיג מהדור השלישי. במידה והמחלה לא מגיבה לטיפולים אלו ישנה אופציה להשתלת מח עצם. במקרה שלי, במשך יותר משנה וחצי, נטלתי כדורים משלושת הסוגים הראשונים, כשתופעות הלוואי שלהם היו קשות מאוד והתשישות ליוותה אותי לאורך כל היום. הייתי מוכן לספוג ולהתמודד עם כל ההשלכות של הטיפולים הקשים, אך לצערי, הגוף שלי היה חסין לטיפול והכדורים לא הצליחו להילחם במחלה.
הזמן עבר, מצבי הרפואי היה רחוק מלהשתפר ובינתיים שקעתי בדיכאון עמוק. קשה לראות איך הרצון להלחם במחלה הארורה, הרצון לנצח ולהתגבר על כל המכשולים הפיזיים שבדרך, נעלם ברגע בו מבינים שאין דרך להבריא.
במרץ 2013, חלה תפנית בעלילה. נמצאתי מתאים לתרומת מח עצם. למעשה, תרומת מח עצם עשויה הייתה להציל את חיי וזו הייתה האופציה הקשה אך ההגיונית ביותר. התכוננו לשלב הבא במלחמה, אשפוז של חודש ימים בבי"ח, במחלקה ההמטולוגית-אונקולוגית. הכינו אותי לקושי שבהחלמה מההשתלה, לסיכויים שהיא אולי לא תיקלט, לאשפוזים החוזרים ולתפקוד החלקי המצופה לי לאורך תקופה ארוכה לאחר מכן. בחשש גדול ובתקווה רבה נכנסתי לניתוח ואכן ההשתלה עברה בהצלחה. עתה 'רק' נותר לי להתמודד עם השיקום הקשה.
המעבר החד בחיים שלי, מבחור רגיל ועצמאי שעושה הכל לבדו, לבחור צעיר אך תלותי וסיעודי ב-90 אחוז לא היה פשוט, לא עבורי ובטח שלא עבור משפחתי. ברגע אחד, הרגשתי איך אני הופך למעמסה, איך אני לא מצליח למלא את תפקידי כאב המשפחה ובעיקר, איך שאני כבר לא מסוגל להסתיר את המחלה מבני הצעיר.
לאורך כמעט שנה, הייתי צריך עזרה בהכל, גם בדברים הפשוטים ביותר. לא יכולתי לנהוג לבד, לקום ולאכול, ואפילו בכדי לעשות את צרכי הייתי צריך סיוע צמוד. למשך תקופה ארוכה, ארוכה מדי, בה הייתי מרותק למיטה, בני הצעיר, אז כבר בן 8, היה חשוף לחולשתי הרבה ודאגתו הייתה ניכרת.
תחושה של אב שרואה את בנו דואג לשלומו ולחייו היא תחושה שאני לא מאחל לאיש. לצד הקושי הפיזי הרב והשיקום הארוך, באוויר ריחפו שאלותיו של בני: "אבא הולך למות?" "אבא יהיה בבר מצווה שלי?" "למה אבא עוד פעם חולה?". רק הזיכרון של זה מחזיר לי את המחנק בגרון. לך תסביר לו שאתה מקווה מאוד להיות איתו כל חייו. בשלב הזה, כמובן שכבר לא היה אפשר להסתיר את המחלה והוא היה חשוף להכל, לא כמו בשלב של הטיפול הכימותרפי.
החודשים התקדמו, ואיתם הרצון העז שלי לחזור ולרוץ. הרופאים כמובן התנגדו. 'זה יחליש אותך', 'אתה תרגיש רע', 'אתה תסבול מכאבי תופת' ועוד. האמת? הם צדקו בכל מילה. בכל פעם שניסיתי להביא את עצמי לעשות פעילות פיזית מינימאלית, סבלתי מכאבי שרירים מטורפים לאחר מכן, שלעיתים אף העירו אותי באמצע הלילה ומנעו ממני שינה. הירידה המשמעותית במשקל אכן החלישה אותי מאוד וגם כשרציתי לצאת לפעילות זה לא מאוד הצליח. אבל לא וויתרתי, לאט לאט חזרתי לרוץ, ובכל פעם גדל הטווח.
היום, כשנתיים לאחר ההשתלה, ניתן לומר שקיבלתי את חיי בחזרה, באופן כמעט מלא. המערכת החיסונית שלי, שהיא הנפגעת המרכזית של ה–CML, עדיין חלשה ופגיעה מאוד ואני נדרש לעבור סדרת חיסונים אחת לחודש בבית החולים. מעבר לכך, אני לא מתפקד בצורה דומה לשאר בני גילי. אחרי מספר שעות של עבודה אני כבר מרותק לחלוטין ולא מסוגל לקיים פעילות קטנה כגדולה בחצי השני של היום. לכן אני עובד רק חמש שעות בכל יום חול. והריצה? אני משתדל לפנות לה את הזמן בעיקר בבקרים, אבל לא בכל יום. כשנה לאחר ההשתלה רצתי את חצי מרתון חיפה ולאחר שנתיים סגרתי מעגל, כאשר רצתי את מרתון תל-אביב המלא. וכן, גם השנה רצתי את המרתון. היום אפילו הבן שלי מצטרף אלי לריצות של חמישה ק"מ. בלי צל של ספק, הריצה, לצד משפחתי התומכת וחברי, עזרו לי להשתקם ולהלחם בסרטן.
מכאן, אני שולח את תודתי לתורמת מח העצם שהעדיפה להישאר חסויה ולא לפגוש אותי. נתת לי את חיי בחזרה. ולכל מי שכמוני קיבל את מכת הסרטן, את אחד מארבעת הסוגים של סרטן הדם או את ה-CML, הלוקמיה הקשה והקטלנית, דעו שיש עוד תקווה. החיים אומנם לא חוזרים למתכונתם המוכרת והבריאה, אבל מה שחשוב הוא, שיש סיכוי לחיות.* אילן ליינר, חולה CML, בן 39 מצפון הארץ.
הדבר הכי מוזר בסרטן שליהוא שידעתי שאני חולה. זה היה לי ברור. לא ברמת התהיה, החשיבה, אלא ברמת הידיעה. שבשרו לי את האבחנה חשתי הקלה…לא נעים להודות…מהולה בשמחה.
חודשים של חלומות מסוייטים, של הרגשה שאוטוטו נגמר פרק טוב בחיי, שמתקרב אליי משהו נורא ואני כמעט ויכולה לחוש את צעדיו, שגל ענקי מאיים להטביע אותי. מרופא לרופא הגעתי עם סלקל ותינוק קטן ומודיעה חגיגית ש"יש לי סרטן. עזרו לי לגלות מהו". הפניות לפסיכיאטר, מרשם לציפרלקס והמתנה לבדיקות דם שהגיעו בדיוק חודש טרם האבחנה בשעה 23 בלילה, אוששו את מה שידעתי הרבה הרבה קודם. כן. זה סרטן…לוקמיה…רק לעזאזל…מה הסוג??? משם התקף חרדה במיון, תסחיף ואשפוז בטיפול נמרץ, דיקור מח עצם ואבחנה. יש לי CML.
הדבר הכי כואב בסרטן שלי הוא שהוא בא לי דווקא כשהכי לא רציתי. כאילו מבין כל הרגעים בחיי…נבחר הרגע הפחות טוב מכולם.
21/5/13….עם תינוק בן חודשיים…שכל מה שביקשתי היה לחבק אותו חזק ולא לעזוב.
שיתבונן בי…ואני בו…שיאהב רק אותי ושלרגע לא ניפרד. רגע… ביקשתי מהחיים. תנו לי רק עוד קצת. רק עוד טיפה…הפרדוקס העיקרי בפירוד בשלב כזה הוא שהרגשתי שארי הוא חלק ממני, מגופי, מעולמי הפנימי. הקרע ממנו היה כמו כאב פנטום. חשתי אותו תמיד ובכל מקום ולא היה לו מזור.
הדבר הכי הזוי בסרטן שלי הוא שאי אפשר להתפטר ממנו…הצורך הראשוני של אדם שכרגע בשרו לו שהוא חולה היא לצאת למלחמה על בריאותו. רוב האנשים מוכנים לעשות הכל כולל הכל ובלבד שבריאותם הפיזית תשוב אליהם.
מסעות המלחמה ההירואיים שעוברים אנשים חולים בדרכם לטייטל "בריא" הם אולי המסעות הקשים ביותר בהם עוברים בני האדם.
אז ביקשתי…התנגדתי לטיפול…התחננתי לבצע השתלת מח עצם כאשר מאחור עומדת בקשה פשוטה אחת…"אני רק רוצה להיות בריאה". לא יכולתי לקבל את העובדה שאצטרך לחיות עם הסרטן שלי. לנצח. עבורי זו הייתה בקשה מוגזמת מידי. הסתכלתי כאילו מלמעלה על מרחקים עצומים שגם האופק לא נראה בהם וחשתי יאוש גדול. טיפול…בדיקות…רופאים…תופעות לוואי….שנים. אלוהים, איך עושים את זה מגיל 30?
הדבר הכי מופלא בסרטן שלי הוא שעברתי את כל שלבי האבל ממש בכמה ימים ואם לדייק, ביום שבת אחד נורא מכל.
זה התחיל עם התקף חרדה לפנות בוקר בו אני מתעוררת ולא מאמינה שזה קרה לי…אני מתעוררת לדמות אחרת, עולם אחר, זר לי. אני מתבוננת בחלון, השמיים שינו את צבעם. אני מתבוננת במראה בהלם ורק שאלה אחת עוברת במוחי…שוב ושוב, שעות…"אלוהים, אני חולת סרטן? באמת?"
חצי שעה אחרי, אני זועמת. אני מרגישה את הכעס משתלט עליי ומתפשט בכל גופי. אני זועמת על כולם, בעיקר על הקרובים אליי ביותר שלכאורה לא הגנו עליי מפני המפלצת הזו שנכנסה לעולמי בלי התראה.
אחר הצהריים דיברתי הרבה עם אלוהים. הבטחתי לו כל מיני הבטחות שאני כבר לא ממש זוכרת העיקר שיקח את זה חזרה ממני. "זה לא קשור אליי בשום צורה אדוני הנכבד…בבקשה. קח את זה חזרה…אעשה הכל"…אחרי שזה לא קרה,חשתי את צער העולם ובכיתי בכי שמאן להסתיים כחמש שעות רצופות. הסתכלתי במראה אחרי שסיימתי לבכות ולא ממש האמנתי למה שאני רואה. התמונה הייתה עגומה במיוחד, כך גם מצבי.
בלילה, באופן מפתיע, כבר קיבלתי עליי את הטייטל "חולה" בצורה מרשימה ודיברתי עם מנהל העמותה גיורא. קשה להבין מהי התמיכה הזו עבור חולה חדש שאובחן לשמוע קול של אדם שאובחן לפני מספר שנים לא מועט והוא נשמע בוטח, חיוני ומנהל עמותה שכל מטרתה היא לסייע. בשיחה אחת הכרתי קצת יותר את המחלה שלי, הטיפול העומד לרשותי, האופציות המועדפות ובכלל… קולו השמח והבוטח שידרו לי שאני חייבת לצלוח את המשבר הזה כי זה אפשרי. ממסך עלטה גמורה הוא האיר לי את כל המידע הדרוש לי ובעיקר, הוא פתח לי דלת לבית חם ועד היום האיש היקר הזה הוא חלק בלתי נפרד מהמסע שלי.
הדבר הכי מרגש בסרטן שלי הוא שימור הפוריות שלי.
אני מיילדת. עולם התוכן שלי מורכב, רובו ככולו, מנשים הרות, תינוקות מתוקים ואהבה. אני מחוברת לקשר בין אם לתינוק בכל איבריי, הקשר הזה, מקודש בעיניי…אני כל כך אוהבת תינוקות. הם מכמירים את ליבי כל אימת שאני פוגשת בהם. באופן אוטוטי כמעט ידיי ניגשות לחבק, לקרב. זה גדול ממני…
ידעתי שהטיפול טרטוגני, שסביר להניח שהגוף לא ישאר כשהיה, שאני הולכת להיחלש יותר ויותר עם השנים והתעקשתי על שימור פוריות. ביצעתי את השימור, למורת כל המלצות הרופאים שהתריאו מפני קריסה כיוון שהייתי לאחר לידה, בלתי יציבה עם סיכון ממשי לחיי בתהליך כה מורכב. ואכן…הסתבכתי כהוגן…דימום בלתי נשלט, עוד מס' שבועות של אשפוז ואני…שרק עכשיו מבינה שההתעקשות שלי לא ב א מ ת הייתה על מנת לשמר פוריות. לא. באותו רגע לא חשבתי על ילד נוסף. רק רציתי להוכיח לעצמי שאני כן אוכל ללדת.
שימור הפוריות ביטא קול צעקה. צעקה רמה יותר מצעקת ה"אל תגידו לי שאני חולה". זו הייתה צעקה שבקעה מהכאב הכי נורא שאשה יכולה לחוש.הפחד הנוראי הזה שלא תוכל עוד ללדת. וזה שיתק אותי.
הדבר הכי מטלטל בסרטן שלי היה שאחרי חודשיים של סבב אשפוזים מפרך חזרתי לתינוק שלי…שהוא מתבונן בי אך לא מכיר…מתבונן בי…ובוכה… מסרב להיקשר לדמות שהייתה אמא שלו, נעלמה והחליטה לפתע לשוב חזרה. אין כאב גדול לאם מתינוק שלא מכיר בה. אין תחושת כישלון גדולה יותר למבחן האימהות.
הדבר הכי מצער בסרטן שלי הוא הבדידות לאחר האבחנה.
אחת הבעיות הקשות ביותר בסרטן כרוני הוא אובדן משאבי התמיכה. אז בימים- חודשים הראשונים התמיכה והאהבה עצומים. ביקורים…הודעות…שאלות לשלומי…מתנות והפתעות…מין חיבוק לוחץ, לעיתים אפילו מעיק של כל האנשים שאהבו אותי. כך לפחות חשבתי אז.
ואז ההתרופפות. האמת היא שזה די קורה ברגע, גם מהאנשים הכי הכי קרובים. פתאום יש עזיבה. עזיבה המונית. המשבר האקוטי חלף, החיים, כאמור חזקים מהכל. כוח האינרציה לא מותיר מקום לעיכובים.
התחושה קשה. קשה מנשוא. הבעיה הגדולה היא שהעזיבה קורית בדיוק בדיוק כשנופל האסימון והמחלה מקבלת מימד ריאליסטי…ומתחשק לי לצעוק לכולם…"היי, חיזרו. עכשיו אני צריכה אתכם. ממש ממש עכשיו."
לא עבדתי, המעגלים החברתיים הצטמצמו באורח טבעי, חשתי שאני מתבוננת בחלון ושם, החיים חולפים כרגיל…ואני…אני נותרת באותו המקום.
הרגשתי שקיבלתי אבחנה נוספת. שמה: בדידות.
הדבר הכי מפתיע בסרטן שלי הוא שינוי הגוף והמראה נוכח הטיפול…זה היה מהיר. מהיר ועצבני. תופעות הלוואי היכו בי במהירות, ללא רחמים והפכו אותי תלויה ממש בחסדיהם.
לא הכנתי את עצמי לעוצמה בו כדור אחד ביום יכול לשנות את המציאות שבי. מחלה כרונית אמרו לי…כדור אחד ביום???וכך אני מרגישה?
מבחורה כל יכולה הפכתי ממש לחצי סיעודית. כאבים קטלניים, חולשה שלא מאפשרת לי לעמוד, הסננה קשה בעצמות, כאבי ראש בלתי נתפסים ועוד רבים וטובים. לא הכרתי את הגוף שלי. לא הכרתי את החיים שלי, לא שיערתי גם לא בדמיוני הפסימי ביותר שתוך מס' שבועות חיי ישתנו לבלי היכר. כל פעולה שביצעתי הצריכה ממני מנוחה, כל מספר שעות עם ארי הזדקתתי להפסקה. בדיקות, הפניות, בירוקרטיות, תרופות לתופעות הלוואי… התייאשתי. ממש התייאשתי. בכל מובן אפשרי.
חשבתי שאשאר בריאה לנצח. לא שיערתי מעולם שיום יבוא, יום אחד כזה…רגיל…סטנדרטי וחיי התהפכו להם כך, מבלי שאוכל לזהות אותי בהם. עד היום אני מתבוננת במראה ומנסה להיזכר או לדמיין איך הייתי נראית אם לא הייתי נפגשת עם הסרטן שלי.
אולי הייתי יפה יותר? רזה יותר? פחות בצקתית? בלי שקיות מתחת לעיניים? בלי הכאב הזה שאני לא מצליחה להתפטר ממנו…אני כנראה מתכוונת גם לכאב הנוסף שלי. העיקרי. בלב.
הדבר הכי כיפי בסרטן שלי הוא שבמרוצת הימים, הצלחתי לפתע להתבונן בשמיים. זו לא הייתה התבוננות רגילה. פתאום ראיתי אותם…את השמיים שהיו שם כל הזמן, הצבע שלהם, השמש הזורחת מבעדם, הציפורים החגות שם למעלה…משוחררות מכל דאגה.
נדמה היה לי שלא הכרתי את כל מה שמקיף אותי בכזו טבעיות, כנראה שתמיד הנחתי שיהיה שם, יחכה לי.
הבדיקות מידי 3 חודשים לוודא שאני עדיין יציבה גרמו לי לחוש ממש ברת מזל. קיבלתי את התוצאות ורצתי הבייתה…"יש…יש לי עוד 3 חודשי מתנה". זה פיקס אותי, נתן לי כל כך הרבה פרופורציה ומשמעות למה שמספר חודשים קודם היה כל כך מובן מאליו ועתה…כאמור, הפך ללא מובן כלל!!!
לקחתי את ארי ממש מידי יום, לעיתים מס' פעמים ביום אל הים…
נגענו במים ובחול, עצמנו עינים והקשבנו לשקט. הכל נצץ סביב. הרגשתי שחושיי מתחדדים, שאני במציאות אחרת, מוערכת, מרהיבה, שכל יום ניתן לי במתנה וזו חובתי מעכשיו. להנות מזה…כי מחר…אין לי את מחר. יש לי רק את היום.
הדבר הכי מוחלט בסרטן שלי היה הרצון להקיף את עצמי רק באמת. עד הסרטן שלי, הייתי מאוד נייטראלית, מתפשרת, מוותרת, מרצה. פחדתי להכאיב, לגעת שלא אפגע…הקפתי את עצמי גם בחברים שלא התאימו לי, שלקחו לי יותר משנתנו…אם בכלל, שלא באמת אהבו…שגם החיבוק לאחר המחלה היה סוג של תקשורת צהובה עבורם ותו לא. חשתי את זה עוד לפני, הרבה לפני…אך הסרטן החליט שדי.
הקשרים נותקו, התנתקו, אני קיבלתי מימד אחר לחיי…רציתי שיהיה לי טוב כי מגיע לי. לא הצלחתי להכיל מה שהיה קודם, לא הצלחתי כבר להתפשר על כאילו, לא הייתה בי הסובלנות לחבק את מה שלא רציתי לחבק בכל מאודי והנחתי לקשרים לדעוך…הסרטן שלי הביט בי, מרוצה. נרגעתי…התחושה הייתה טובה…שלווה…נעימה…הבטן שידרה לי אמת. עשיתי את הדבר הנכון.
הבחירה בחיים הייתה לנקות מחיי דברים שלא נכונים עבורי. לא לחיות מכוח האינרציה…אלא לחיות מתוך אמת פנימית והשלמה. אנשם לא מבינים כמה כוח והשפעה יש לחברים ולמי שמקיף אותנו בחיינו.
הכוח מתגלה בזמן משבר, משבר כזה בו צוללים למצולות. כיום אני יודעת מה הכוח שלי. מי נקודת האור שלי, מי היה שם כל הזמן ולא וויתר עליי. המשפחה שלי.
הדבר הכי נועז בסרטן שלי הוא שהחלטתי לא לוותר. אני והסרטן שלי סיכמנו שאנחנו הופכים לחברים. אם אני לא יכולה לנצח אותו ואני מקווה שהוא לא יחליט לנצח אותי בקרוב, אז לפחות שיתן לי לחיות כמו שאני רוצה…או לפחות מקווה.
יום אחד החלטתי שזהו. אני מתכנתת את המחשבה שלי מול כל כוחות הגוף. אני מחזקת את המחשבה שלי שאין משהו שלא אוכל לעשות, המוח שלי ממש הושיט את ידו אל הגוף וסייע לו לקום. כל יום מחדש.
חזרתי לעבוד בתור מיילדת, החלטתי להגשים חלום ועבדתי בעוד עבודה בתור מרצה בתחומי. סביב השעון, לא מעט פרויקטים, עבודה לא פשוטה, פיזית לעיתים קרובות, תובענית ואני…שמס' חודשים קודם לא הצלחתי לעמוד, פתאום…מתפקדת.
זה לא היה פשוט…בכלל לא פשוט…אינסוף חודשי הסתגלות, תופעות לוואי שהחמירו, תשישות וחולשה קשים מנשוא, סיוע של כל מי שיכלתי לנדב לתחילת המסע ומוח אחד שעומד מול כולם וצועק: "לא תנצח אותי".
מס' שנים לאחר מכן, ואני מחזיקה מעמד, מתרגלת, מאמצת למוחי את הרעיון שנכון. לא הכל בראש אבל הרוב כן. נכון…יש לי אבחנה בתיק הרפואי…נכון…אני קוד מחלה קשה…נכון…אני מבקרת בהמטואונקולוגיה ומכירים אותי בתור חולה כבר שנים..סביר גם להניח שיש לי הרבה יותר תרופות מאדם בן 80 אבל היי…אני בריאה!!!
אני בריאה כי הקשר שביצעתי בין הגוף החולה שלי ובין הנפש שלי נותק. אני בריאה כי אני חיה בין אנשים בריאים ומרגישה טוב. רק חולים מבינים כמה קשה לחולה לחוש נורמטיבי בחברה בריאה. בתחילה הרגשתי זרה, יוצאת דופן, כל כך שונה. לקח לי זמן והרבה עבודה עצמית להרגיש נוח וטוב…לחייך מכל הלב בהשלמה. אני, מוריה, בריאה. הגוף שלי…חולה. אבל לא לדאוג…בזכותי הוא יבריא, אני אעזור לו.
הדבר הכי שפוי בסרטן שלי הוא סדרי העדיפויות החדשים שלי. לקח לי המון זמן לעכל…להבין…שעכשיו אני בראש סדרי העדיפויות. הבריאות שלי, המנוחה, רווחתי הנפשית, היכולת להציב לעצמי את הגבולות מתי אני יכולה ומתי לא…מתי צריך לעצור ולתת לגוף הפוגה ומנוחה ומתי להמשיך.
אני כבר לא דוחקת בעצמי כמו פעם…אני מבינה שאני פשוט לא יכולה ועליי לשמר את כוחותיי לעוד לא מעט זמן.
הורדתי הילוך, אני ממעיטה באינטראקציות מרוקנות, שומרת כל רזרבה עבורי ועבור הדברים החשובים לי בחיי, נזהרת מאוד לא להגיע למצבי קיצון שאני יודעת ומודעת שהם פוגעים בי.
הפסקתי לרצות…זה דפוס שחי בי שנים…הוא עדיין קיים אך מוגבל וממודר. אין לו כבר סיכוי להשתלט עליי, אין לו כבר יכולת להפוך אותי למה שאני כבר לא.
התפכחתי. אני יודעת בדיוק מה מתאים לי ומה פחות ועבורי זו לא רק דרך חיים אלא משהו שאין לי הרבה ברירות אלא לעמוד בו לאורך שנים. מין אמנה לא כתובה ומוסכמת ביני לבין המודע והתת מודע שלי לשמור על שפיות ועל יכולתי לתפקד כאילו כרגיל.
הדבר הכי בלתי צפוי בסרטן שלי הוא החלומות החדשים שלי.
לאור ההתמודדות הלא פשוטה לאורך השנים, ימים, שעות, דקות… אני חולמת. עדיין חולמת…מה שמעניק לי את היכולת לחלום היא התקווה. גיליתי, שהכוח החזק ביותר לחולה היא תקווה. אין משמעות לזמן ממושך, אפילו שנים לכוחה של תקווה…אם כל חולה יקבל תקווה קטנה הוא תסייע לו לצלוח את הכל בצורה אחרת.
ארבע שנים לאחר האבחנה כתבתי את הספר שכל כך רציתי…ספר ילדים שמספר על קבלת האבחנה של האם מצד ילד קטן, החיים שלו לצידה, הבגרות המוקדמת ההכרחית כל כך…
זה נושא שנגע בי. האינטראקציה ביני לבין ארי והמחלה ריגשה אותי כל פעם מחדש. הידיעה/ לא ידיעה שלו, איך שהוא מביט עליי בימים הלא פשוטים, הקשר שלו אליי ובעיקר התהייה שלי והפחד הנורא כיצד הוא יגיב…
למזלי, שלח לי האל נשמה מיוחדת, בוגרת ומבינה כל כך. ארי הוא עזר כנגדי. הוא האור שלי עבורו אני מתעוררת כל בוקר והנחמה שלי בסיומו של יום. מפתיע איך בשאר התחומים אני חולמת די בגדול אבל דווקא במה שקשור בו זה מזוכך לי לגמרי…אני והוא זה כל כך מספיק לי מול כל הפחד. כל רגע הוא רגע שאני נוצרת, מודה עליו. שום דבר כבר לא נתפס כמשהו שישנו לתמיד.
החיבוק שלו מרפא אותי, מילות הדאגה כלפיי בקולו התמים מסירות ממני כל תחושה קשה איתה אני מתעוררת. זה כמו טיפול יומיומי שהכרחי כל כך לקיומי.
אז אני חולמת…יש לי עוד כל כך הרבה להגשים…אבל החלום היחיד שלי בקשר לארי זה זמן. אני רוצה איתו זמן…את כל הזמן שבעולם.
אם אסכם את תחושותיי במשפט אחד…למרות הכל…הטוב, הרע, והלא נורא…הסרטן שלי הוא הדבר הטוב ביותר שקרה לי.
חשבתי הרבה איך להתחיל לכתוב… ולבסוף החלטתי להתחיל משיחת הטלפון… בשש בערב הייתי אצל הוריי ורופא המשפחה שלי צילצל וביקש שאגיע דחוף אל המרפאה. אני זוכרת שאמרתי לו: "ד"ר אזוב, המרפאה סגורה בשעה כזו, מה כל כך דחוף?" הוא ביקש שאגיע עם קרוב משפחה. הגעתי.
אני זוכרת את הפרצוף שלו, לבן ועצוב. ד"ר אזוב הוא רופא המשפחה שלי, הוא מכיר אותי מילדות. רק משפט אחד אני זוכרת מהיום הזה: "יעל, משהו נורא קרה, תסעי מהר לתל השומר". לא שאלתי דבר, לקחתי את דף הבדיקות שנתן לי ונסעתי עם אבי למיון של תל השומר, שם הראתי את הדף הבדיקות שלי. לכולם היה את אותו פרצוף כמו הרופא שלי, פרצוף עצוב וחיוור. בתוכי הבנתי שהחיים שלי עומדים להשתנות. אני זוכרת את עצמי יושבת, לא ממש מבינה מה אני עושה פה… אני מרגישה מעולה, הכול רגיל. אחרי שעתיים בערך ביקשו שאלך לסוף המסדרון, שם ממתין לי רופא. נכנסתי עם דף הבדיקות שלי.
ואז פצצה. פשוט אין מילה אחרת שתתאר את זה.
"את חולה," הוא אמר, "בלוקמיה. אנחנו לא יודעים באיזה שלב אבל המצב לא טוב."
אני זוכרת שקמתי והתחלתי לרוץ במחלקה, לרוץ ולצעוק, לקלל את כולם. רצתי עד החנייה ולא עצרתי. בכיתי עד שנפלתי, בדיעבד אמרו לי שהתעלפתי, והתעוררתי בבית חולים. המשפט הראשון שאמרתי למשפחתי: "האם אני עומדת למות?"
מכאן הכול התחיל. מסע מטורף לא צפוי. אני יעל, שכל חיי בריאה וחזקה ובעיקר שמחה, הפכתי לאדם אחר- עצוב, כועס, מפוחד, ובעיקר לא מבין איך זה קרה דווקא לי. השיחה הבאה הייתה יום אחרי הבשורה. הוסבר לי שאני חולת CML, שיש לכך תרופה, ושניתן לחיות עם המחלה הזו. בסך הכול כדור…
לאחר ההסבר הרופאה הטילה פצצה נוספת: "את בהריון". אני זוכרת שקפצתי מהכיסא משמחה. לי ולרועי היה קשה מאוד להביא לעולם את יהלי שלנו. שלוש שנים של טיפולים, הפריות וסבל נוראי. ועכשיו זה הגיע טבעי, לבד, בדיוק כמו שרציתי. יהלי בת עשרה חודשים ויהיה לה אח/אחות, חברים כמעט באותו הגיל.
"זאת לא בשורה משמחת…" ככה הרופאה אמרה. "מפה את הולכת לוועדת הפלות ומפילה. לא תוכלי להביא ילדים, לפחות לא בשלב הזה. הגוף שלך לא יעמוד בזה ואת צריכה להתחיל דחוף טיפול תרופתי."
אני זוכרת שבכיתי, לא יכולתי להפסיק. גם רועי בעלי בכה. אני זוכרת שביקשתי ממנה לשאול… אולי בכל זאת? מישהו, רופא, עוד חוות דעת… התחננתי, ממש התחננתי, ביקשתי שוב: "האם יש רופא בישראל שאולי חושב אחרת, שניתן להשאיר את העובר?"
נאמר לי לא מוחלט.
"את בסכנת מוות, אין שום אופציה. תלכי ותפילי."
וכך עשיתי בכאב רב.
ויתרתי על החלום של משפחה גדולה. אני יעל, שכל כך אוהבת ילדים, שבחרה להיות גננת מאהבת ילדים, מבינה שהחלום הזה כבר לא יתגשם. בכל זאת בתוכי האמנתי שאין מצב שלא יהיה ליהלי שלי אח או אחות.
חלפו להם שש שנים… החלום להביא ילד נוסף לא נשכח. כל פגישה עם הרופאה שלי הייתי שואלת: "מתי? מתי תאפשרי לי לנסות? הגיל שלי לא משחק לטובתי, בת 37, זה חייב לקרות בהקדם…"
כל פעם אותה תשובה: "לא! זה בלתי אפשרי".
ואז הגיעה השיחה… הרופאה שלי כנראה הבינה שאני לא מתכוונת לוותר.
"יש לך חלון הזדמנויות, שלושה חודשים ללא תרופות, להיכנס להריון. אני מציעה לך לא לנסות טבעי כי אין לך הרבה זמן. תתחילי טיפולים, שאיבת ביציות, ותתחילי לנסות הפריות."
כמה שמחתי. זה קורה, המחלה לא ניצחה אותי! יהיו לבת שלי אח או אחות…
חזרתי הביתה קורנת. בישרתי לבעלי את הבשורה המשמחת והתחלנו באופן מיידי. הטיפולים לא היו קלים אך עברתי אותם בשמחה גדולה. הכול היה שווה את זה. לשמחתי הצלחתי לשאוב מספר רב של ביציות, כך שהייתי אופטימית שזה הולך להצליח. אך כל ניסיון נכשל. כל ניסיון כושל ריסק אותי. הרגשתי שהגוף שלי בוגד בי, מסרב לאפשר לי להגשים את חלומי. בניסיון האחרון אני ורועי לא נרדמנו כל הלילה. ידעתי שזאת הפעם האחרונה ולא תהיה נוספת… גם הוא נכשל.
ואז שוב שיחה עם הרופאה שלי.
"יעל, תוותרי, זה לא יכול לקרות. תשלימי עם זה, יש לך בת אחת, תגידי תודה ותמשיכי לחיות."
היא לא ידעה שהרגשתי מתה… אותה יעל השמחה, האנרגטית, יעל שחלמה כל כך הרבה חלומות, הפסיקה לחלום. נכון אני חיה ונושמת אבל בפנים הכול מת. ידעתי בתוכי שרק ילד יגרום לי לחיות שוב…
יצאתי.
המשפט הראשון שאמרתי לבעלי: "יוצאים למלחמה, ואין לי שום כוונה להפסיד."
המסע שלי מתחיל כאן. אין רופא או רופאה שלא הלכתי אליהם. תשובתם הייתה תמיד זהה: "את לא תוכלי להביא ילדים".
יום אחד הבת שלי יהלי נכנסה אליי לחדר ואמרה לי: "אמא, לכולם יש אחים. למה את לא רוצה שגם לי יהיה?" אני לבד בבית…"
משפט פשוט של ילדה בת שש אך כל כך מורכב. המשפט הזה גרם לי לכאב גדול אך למעשה הציל אותי. הבנתי מה אני צריכה לעשות כדי להבריא, כדי לחזור להיות יעל. הבנתי גם שאין שום סיכוי שלבת שלי לא יהיו אח או אחות. בצעד דרמטי החלטתי שאני מפסיקה את הטיפול התרופתי, לא משתפת את הרופאה שלי ומנסה להיכנס באופן טבעי להיריון. במקביל התפללתי שהגוף שלי לא יבגוד בי שוב, ושאצליח מהר. ידעתי שאין לי הרבה זהמן ושהבדיקות מהר מאוד יגלו זאת.
שלושה חודשים ניסיתי. כל בדיקה שלילית שוב התרסקות ושוב בכי… שוב כעס על כך שזה לא קורה ושאין לי זמן. הבדיקות אמנם תקינות אבל זה עניין של זמן עד שזה יהיה אחרת. חודשים נוספים עוברים וכלום, אני לא בהיריון, לא לוקחת תרופות, ומתה מפחד. המחלה ממתינה לי בפינה, זה עניין של זמן עד שאסון יקרה.
כל פגישה עם הרופאה אני משקרת ואומרת שהכול בסדר, שאני לוקחת בזמן את התרופות ומרגישה מעולה. שהשלמתי עם זה שלא יהיו לי עוד ילדים. בוקר אחד אני מכינה לי קפה, אותו קפה של כל בוקר, ואז רצה להקיא. לא הבנתי למה. אני זוכרת שישבתי במרפסת ונזכרתי בהריון של יהלי, איך שלא יכולתי לסבול קפה. אך לא האמנתי באמת שזה אותו המצב. החלטתי לקנות בדיקת הריון. פחדתי מאוד להתאכזב, המחזור לא איחר לי, אין שום סימן של הריון חוץ מהקאה מהקפה.
ואז זה הגיע… כמו סופה… הגוף שלי חזר אליי, לא בגד בי יותר. הרגשתי שיעל חזרה מהמתים. אני סוף-סוף בהריון!
עשיתי בדיקת דם ויצא חיובי… הצלחתי!
שבוע לאחר מכן, אחרי לילות לבנים, מחשבות ופחדים, נסעתי לפגוש את הרופאה שלי. זאת הייתה הנסיעה הארוכה בחיי.. רעדתי, פחדתי מהתגובה…
אני זוכרת את עצמי מתיישבת ואומרת לה ישירות: "אני בהריון ואין לי שום כוונה להפיל, אז תעזרי לי שזה יצליח… כי הפעם אני מחליטה ואין שום סיכוי בעולם שתשני את דעתי."
הרופאה שלי הביטה בי במבט המום אך הבינה שאין טעם לנסות לשנות את דעתי…
היריון לא פשוט היה לי. בדיקות ואשפוזים… הגוף היה ללא תרופות, חלש. לא ישנתי בלילות מפחד שהמחלה תתפרץ, שהחלום הזה ייגדע. הייתי חזקה, נחושה, מאמינה. כל פגישה עם הרופאה שלי הייתה קשה.
"יעל, עברנו עוד חודש, אני מקווה שלא יהיו הפתעות."
ואני ספרתי את הדקות. את השניות.
"תצא כבר, ילד שלי," הייתי מדברת איתו. "לאמא שלך אין זמן."
ואז הוא הגיע. נסיך, כמו שחלמתי, תינוק מהמם. קראתי לו ארי- גור אריות, לוחם כמוני. תינוק בריא ומהמם שלי. היה שווה הכול. חזרתי לנשום, לחיות.
ארי היום בן שנה ותשעה חודשים. אהבת חיי, נס שלי, כך אני קוראת לו. מסתכלת עליו ועל יהלי שלי ומבינה שיש לי הרבה בשביל מה לחיות…
לא כך דמיינתי את חיי. CML גדעה לי הרבה חלומות ושינתה את מסלול חיי, אך אני חיה איתה בשלום, ורוצה להעביר פה מסר: לא לוותר. אף פעם. הכול אפשרי. אני הצלחתי, גם אתם יכולים…
הכנס השנתי של עמותת CML יתקיים בסוף השבוע 10-12 לחודש ספטמבר 2020
במלון ישרוטל בים המלח
ההרשמה תיפתח בחודש מאי
נא שמרו את התאריך ביומניכם
ASH 2018
טיפול ב-CML במהלך הריון
נוסחא וניסיון של בית חולים המרסמית בלונדון- דר דרגנה מילושביץ
נכתב על ידי יאן גייסלר ושוכתב על ידי שרף גיורא
במסגרת פורום האינטרנשיונל CML פאונדשין שהינו גוף של רופאים מומחים ל- CML מכל רחבי העולם שהוקם על ידי פרופ ג'ון גולדמן המנוח, ובהנהגתו של דר טים יוז מאוסטרליה בכנס ה- ASH 2018, הוועידה השנתית של האגודה והאמריקאית להמטולוגיה, פרופ' דרגנה מילושביץ' מבית החולים האמרסמית' שבלונדון, בריטניה, הסבירה על הטיפול ב-CML לפני כניסה להיריון ובמהלכו, במיוחד כאשר נשים הרות מאובחנות במחלה, או כאשר חולות CML העוברות טיפול במעכבי טירוזין קינאז (TKI) מעוניינות להיכנס להיריון.
במדינות המערב, כ-7.5%-12% מקרב חולי CML הם בני פחות מ-29 שנים בעת אבחון המחלה. במדינות מתפתחות, הגיל החציוני לאבחון CML הוא בין 30-40 שנים, כך שקיים צורך חזק לדון עם אותם חולים צעירים בתכנון משפחה עתידי. בנוסף לכך, פחות מ-1 מתוך 100,000 נשים הרות מאובחנות ב-CML בזמן ההיריון.
כאשר מאבחנים CML בזמן היריון, אפשרויות הטיפול הזמינות כוללות טיפול באינטרפרון, TKI או הידרוקסיאוריאה, או לחילופין, הפחתה קבועה של תאי דם לבנים באמצעות לויקופרזיס או הפסקת היריון.
לויקופרזיס, הליך שבו תאי דם לבנים מסוננים מתוך הדם, מבוצע על מנת לשמור את ספירת תאי הדם הלבנים נמוכה מ-100,000 ואת מספר טסיות הדם קטן מ-600,000 בזמן ההיריון. תדירות הטיפול משתנה מחולה לחולה ובנקודות זמן שונות במהלך ההיריון: ימים לסירוגין, טיפול שבועי או אחת לשבועיים, כאשר התדירות מופחתת בשליש השלישי של ההריון.
ניתן לתת 6 מיליון יחידות אינטרפרון שאינו פג 3 פעמים בשבוע. Peg-IFN נחשבת לתרופה טרטוגנית בשל הצטברות פוליאתילן גליקול בגוף, אך לא קיימת הוכחה קלינית לבעיה, כך שמטפלים באמצעותה גם במקרים של CML.
מבחינת TKI, היו מספר מקרים בודדים של שימוש באימטיניב במהלך הריון, על אף שפרקטיקה זו אינה מומלצת. (גם בישראל יש חולה שלקחה אימטיניב במשך כל ההריון וילדה ילד בריא). קיימים מעט מאוד נתונים קונקרטיים. לפיכך, ההמלצה לנשים הרות היא להימנע מטיפול TKI. על פי מידע שפורסם ב-2008, 50% מהריונות עם חשיפה ל-TKI הסתיימו בלידות ללא הפרעות מולדות, בעוד ש-50% מההריונות האחרים חוו בעיות.
עד היום לא נמצא קשר בין טיפול באימטיניב בזמן השליש השלישי להריון לבין הפרעות התפתחויות של העובר, על אף שאין מידע קונקרטי התומך בשימוש בתרופה בזמן השליש השלישי.
נטילת הידרוקסיוראה בהיריון דווחה כבעלת השפעות טרטוגניות ומקושרת להזדקנות שלייה ולרעלת היריון. יחד עם זאת, נראה שהיא מזיקה פחות מהמצופה, כפי שדווח ע"י חוקרים באמצעות רישום טוקסיקולוגיה אודות אנמיה חרמשית. NCCN מציין שהידרוקסיוראה הוכח כטיפול בטוח (ראו ,NCCN מדריך ,CML גרסת 2018).
ניהול פוריות ותכנון משפחה צריכים להתחיל באבחון CML ולהתחשב בטיפולים מידיים ועתידיים, ואם הדבר אפשרי, לנקוט מיד בשימור פוריות. השפעות ה-TKI על השחלות אינן משמעותיות.
נילוטיניב חודרת לשלייה (שנוצרת בשבוע 12-14 להיריון) באופן גרוע. יחד עם זאת, קיימים מעט מאוד נתונים ותיאורי מקרים אודות השימוש בה בזמן ההיריון. דסטיניב חודרת את השלייה, מופצת בהרחבה, היא טרטוגנית ויכולה לגרום לבעיות בכל שלב בהיריון. מקרים בודדים של חשיפה לתרופה בזמן היריון הראו דיווחים של 33% יילודים נורמליים, 49% הפלות יזומות, 17% הפלות טבעיות ו-11% הריונות בלתי תקינים.
במקרה של היריון לא מתוכנן יש לבצע הערכת תועלת מול סיכון והתייעצות זהירה עם החולה. יש לאזן בין צרכיהן של אימהות הדורשות טיפול אופטימלי נגד סרטן לבין השפעות טרטוגניות על העובר. מומלץ להפסיק את הטיפול ב-TKI, לא לטפל עד אשר ספירת תאי הדם הלבנים היא מעל 100,000, ולאחר מכן לשקול להמשיך טיפול באינטרפרון. בניסיונות להרות בקרב 35 נשים צעירות שטופלו בבתי החולים של האמרסמית', 72% מהמטופלות איבדו תגובה מולקולרית מלאה (MMR) בזמן ההיריון, 11% איבדו תגובה המטולוגית לחלוטין (תאי דם לבנים ו/או טסיות מחוץ לגבולות הנורמה), ואצל רוב החולות 90% (אך לא בכולן) שבה תגובה מולקולרית מלאה לאחר ההיריון וחידוש טיפול.
העצה השגרתית שניתנת לנשים העוברות טיפול ב-CML בבית החולים האמרסמית' ורוצות להיכנס להיריון היא: עליהן להיות בתגובה מולקולרית מלאה (MMR) במשך 24 חודשים לפחות, תקופת המתנה בין הפסקת הטיפול לכניסה להריון אינה הכרחית וניתן להפסיק את הטיפול, למשל, בתום מחזור הווסת.
במהלך ההיריון, החולות צריכות להיות במעקב קבוע עם PCR ולא להתחיל טיפול כל עוד המטופלת נותרת ב-MMR או CMR. אם ה-PCR מתחיל לעלות, ניתן לטפל באינטרפרון החל מהשליש השני. לאחר הלידה לא מומלץ להניק. יש לבצע בדיקת שקיפות עורפית בשבוע 11-13.
לסיכום, הנוסחה המוצעת לניהול היריון אלקטיבי בזמן טיפול ב-CML וניהול טיפול לאחר אבחון CML בהיריון בבית החולים האמרסמית' הודגמה בגרף המצורף ופורסמה ב-2014.
ASH 2018
סיקור המאמרים על אימטיניב גנרי לעומת גליבק מקורי
נכתב על ידי יאן גייסלר ושוכתב על ידי שרף גיורא
כאשר אימטיניב הגנרית הוצגה לציבור בין השנים 2013-2016 לאחר שפג רישום הפטנט של גליבק, נוסחאות גנריות רבות הוכנסו לשימוש כטיפול זול יותר מתרופת המקור. עם זאת, יש מעט מאד מחקרים שהעריכו באופן פרוספקטיבי את היעילות והבטיחות של תרופות גנריות אלו. עם הצגת תרופות גנריות אלה, מטופלים ורופאים רבים חששו מיעילותן ובטיחותן לעומת התרופות המקוריות, אולם אף מאמר מהשווקים המפוקחים יותר כמו אירופה וארה"ב, לא הוכיח חששות אלו.
בוועידת ASH השנה שני מאמרים עסקו באימטיניב הגנרית – מחקר תצפיתי מברזיל, ארגנטינה ואיטליה אודות טיפול קו ראשון עם אימטיניב מקורי וגם גנרי, ומחקר תצפיתי מאיטליה על מעבר מגליבק לאימטיניב גנרית.
נתונים ממחקר תצפיתי מברזיל, ארגנטינה ואיטליה
ד"ר קטיה ב. פגאנו מברזיל הציגה מחקר תצפיתי רב מרכזי שעסק ביעילות ובבטיחות של אימטיניב גנרית בהשוואה לגליבק. במחקר השתתפו 160 חולים מברזיל, איטליה וארגנטינה, אשר טופלו בק ראשון באימטיניב גנרית בין ינואר 2015 לספטמבר 2017. התוצאות של קבוצה זו הושוו אל מול קבוצה של 285 חולים שהחלו טיפול בגליבק בין ינואר 2010 לדצמבר 2011, כחמש שנים קודם לכן.
החולים שטופלו באימטיניב גנרית היו בממוצע צעירים יותר (50 לעומת 55 שנים), עם שיעור גבוה יותר של חולים בקבוצת סיכון גבוה (26% לעומת 15% במדד Sokal), וזמן רב יותר עבר מעת אבחונם עד תחילת הטיפול בהשוואה למטופלים בגליבק.
כמו כן, מכיוון שהמטופלים בתרופה הגנרית טופלו חמש שנים לאחר פרסום ההמלצות החדשות של ELN ב-2013, המעקב אחר קבוצת הגליבק בוצע בהתאם לקריטריונים של ה- ELN לשנת 2009, ולגבי קבוצת האימטיניב הגנרי בהתאם לקריטריונים החדשים של ה- ELN לשנת 2013. ההמלצות שונות אחת מהשנייה למשל בהגדרת לתגובה תת-אופטימלית. עובדה זו גרמה לכך שהיה הבדל בין הטיפול הקליני במעבר לדור השני של TKI במקרה של תגובה תת-אופטימלית, מה שהופך את ההשוואה בין הקבוצות לקשה יותר.
כל המטופלים החלו ליטול אימטיניב בשלב הכרוני, פחות משישה חודשים לאחר האבחון. החולים נוהלו לפי המלצות ה-ELN – הרשת האירופאית ללוקמיה – מהשנים 2009 ו-2013. הגדרת התגובות הייתה בהתאם לקריטריונים של ELN ל-2013. יחד עם זאת, הקבוצה הגנרית טופלה מאוחר יותר לפי אבני הדרך של ELN לשנת 2013 ולפיכך עברו מוקדם יותר לטיפול TKI מדור שני במקרה של תגובה תת-אופטימלית.
תופעות לוואי הוערכו בהתאם לקריטריונים לטרמינולוגיה הנפוצה בתחום. לא היה כל הבדל ברעילות בין גליבק המקורי לבין קבוצות המטופלים בתרופות הגנריות.
שיעור כישלון הטיפול לאחר שלושה חודשים על פי הקריטריונים של ELN לשנת 2013 היה 7% ו-16% גליבק מול גנרית בהתאמה, ואילו לאחר שישה חודשים לא היה הבדל משמעותי (12% מול 15%). היו חמישה ושלושה מקרים של התקדמות המחלה בקבוצות של גליבק וגנרית בהתאמה. באופן כללי, שיעור השורדים לאחר שנתיים עמד על 99% בקבוצה של גליבק ו-94% בקבוצת אימטיניב הגנרית.
הקבוצה שטופלה באימטיניב גנרי הציגה שיעור גבוה יותר של כישלון בטיפול לאחר 3 חודשים ושיעורי הישרדות נמוכים יותר, הישרדות ללא התקדמות המחלה והישרדות ללא אירועים במשך 24 חודשים נמוכים יותר.
הערה: באופן כללי, קשה להשוות את הנתונים של 2 הקבוצות בשל העובדה שזהו לא מחקר אקראי אלא השוואה עם נתונים היסטוריים, כשניהול הטיפול בחולי CML בוסס על קווים מנחים שונים וזמינות שונה של TKI דור שני.
בשלב השאלות משתתף העלה את השאלה באילו תרופות גנריות השתמשו, אבל המידע לא זמין עדיין. לסיכום, הנתונים מצביעים על שיעור הישרדות של 94% בשימוש בתרופות גנריות, שהוא גרוע במעט מזה של התרופה המקורית. אולם זה יכול לקרות בשל סיבות טכניות (ניהול החולים בהתאם לקריטריונים שונים של ELN; שיעור גבוה יותר של חולים בסיכון גבוה בקבוצה הגנרית).
השפעות החלפת טיפול מגליבק לאימטיניב גנרי במחקר האיטלקי של GIMS
ד"ר מריה גמלי מאיטליה דיווחה על מחקר העוסק במעבר לאימטיניב גנרית (GIMS), שבחן את התוצאות הקליניות בחולי CML אשר טופלו בחמישה מוסדות איטלקיים המשויכים ל-REL (הרשת הלומברדית להמטולוגיה). החוקרים החליפו את הגליבק המקורי בתרופה גנרית כטיפול קו ראשון, ועקבו וניתחו את יעילות הטיפול ותופעות הלוואי שעליהן דיווחו המטופלים.
במחקר תצפיתי, רב-מרכזי ורטרוספקטיבי על חולי CML בשלב הכרוני והיציב של המחלה (מוגדר כלפחות 18 חודשים של הפוגה ציטוגנטית מלאה ו-36 חודשי טיפול בגליבק המקורי), הוחלפה התרופה המקורית באימטיניב גנרי החל מינואר 2017.
החוקרים השתמשו בארבעה יצרני אימטיניב גנרי: אקורד, רדי, סנדוז וטבע. הם ניתחו את הווריאציות של PCR כמותי בהתאם לתקנים הבינלאומיים (IS). שלושה PCR בוצעו בתקופה של 12 חודשים לפני ההחלפה ועוד 2-3 PCR ב- 12 החודשים לאחר ההחלפה.
התקבלו נתונים מ-109 מטופלים. חציון משך הטיפול באימטיניב היה 9.1 שנים (בטווח של 4.5-18.3 שנים). הגיל הממוצע בזמן ההחלפה היה 57 שנים (בטווח של 18-85 שנים); 46 מהמטופלים היו נשים (42%) ו-63 גברים (58%). מתוך מטופלים אלו, 94 (86.2%) עברו את כל בדיקות ה-PCR הנדרשות, 15 (13.8%) עברו רק שתיים מתוך שלוש הבדיקות לאחר ההחלפה.
השוואה בין תופעות הלוואי לפני ההחלפה ואחריה הראתה הבדל סטטיסטי משמעותי לטובת אימטיניב גנרי ברוב תופעות הלוואי, למעט התכווצויות שרירים והיפרמיה של הלחמית. אף מטופל שעבר לאימטיניב גנרי לא נאלץ לחזור לגליבק המקורי. מטופלים שקיבלו אימטיניב גנרי בפורמולציות קטנות מאלו שבמותג המקורי דיווחו על בליעה קלה יותר של הגלולות.
הנתונים הראשוניים המתקבלים בקבוצה זו של חולי CML מצביעים על כך שלאימטיניב גנרי אין השפעות מזיקות על טיפול ב-CML וכי היא מציגה פרופיל בטיחות מקובל, דומה או טוב יותר מאשר גליבק המקורית. הירידה הסטטיסטית המשמעותית ב-BCR-ABL לאחר החלפה לאימטיניב גנרית מחייבת התייחסות זהירה – נתונים נוספים נדרשים על מנת לחקור את ההיבט זה, שכן ידוע כי ערכי PCR יורדים בצורה מתמשכת לאורך זמן.
נתונים אלה יסייעו להבהיר ספקות וחששות בקרב חולי CML בנוגע לבטיחות ויעילות אימטיניב הגנרי.
ASH 2018
סיכום המושב החינוכי (אדיוקשיונל) על CML
נכתב על ידי יאן גייסלר ושוכתב על ידי שרף גיורא
"ביוני 2018 צוין יום השנה ה-20 לשימוש הקליני הראשון במעכב טירוזין קינאז (TKI), אימטיניב, בחולי .CML מאז, השינוי בפרוגנוזה היה לאחד מסיפורי ההצלחה העיקריים של הרפואה המודרנית במאבקה במחלת הסרטן".
ציטוט זה, שהובא בפתח הסישין החינוכי אודות CML של ASH, הזכיר לי כמה רחוק הגענו במהלך עשרים השנה האחרונות. שני עשורים עברו מאז שחולי ה-CML הראשונים נטלו את STI-571, שנודע לימים כגליבק או אימטיניב, במסגרת יוזמה פורצת דרך של מומחי ,CML בריאן דרוקר וג'ון גולדמן, וכל זאת מול התנגדות חזקה מצד מומחים רבים שסברו כי טיפול ב-TKI לעולם לא יצליח.
היום, כל עוד טיפולים עכשוויים זמינים בפניהם, חולי CML ורופאים אינם חוששים עוד מההתקדמות הבלתי נמנעת של המחלה או מכמה זמן נותר לפני השתלת מח עצם, כפי שהיה ב-2000. כיום ההתמקדות היא בבחירת הטיפול הטוב ביותר, שמבוסס על הביולוגיה המולקולרית הייחודית של המחלה, כמו גם מחלות רקע נוספות של החולה, תופעות לוואי ואיכות חיים.
מטרות הטיפול העיקריות הן להפחית את כמות המחלה במהירות כדי למנוע התקדמות מוקדמת ולהשיג הפוגה מולקולרית עמוקה ואיכות חיים טובה. עבור רבע מהחולים, הפסקת טיפול והפוגה ללא טיפול לאחר שנים רבות של טיפולים היא כבר מטרה הניתנת להשגה.
"עם הצלחה גדולה מגיעה אחריות גדולה" היה המוטו של פאנל הסישין החינוכי ל-CML בוועידת ASH 2018. הכוונה היא שעם כל הבחירות שיש לנו, עלינו לעשות את המירב כדי למנף את האפשרויות התרפויטיות ולתת לכל חולה את הטיפול האפשרי הטוב ביותר, ולעמוד בהבטחה שכל חולה CML יוכל לחיות חיים נורמליים, ארוכים וטובים.
שלושת הנואמים בסישין החינוכי– פרופ' ג'יין אפרלי מבית החולים האמרסמית' בלונדון, פרופ' טים יוז מאדלייד באוסטרליה ופרופ' צ'רלס קרדוק מאוניברסיטת בירמינגהם – הפכו זאת לאפשרות מעשית בעזרת הדגמת ההחלטות הטיפוליות בשני מקרים היפותטיים של חולי CML: בוב, מעשן בן 55 הסובל מעודף משקל ומהפרעות כרומוזומליות נוספות, וסו, אישה הרה בת 22.
שלושת מומחי ה-CML נגעו בשלושה תחומים חשובים: בחירת טיפול קו ראשון, לוחות זמנים למעקב מולקולרי והתקדמות בהשתלת מיח עצם בקרב חולים שעבורם טיפולי TKI לא צלחו.
בחירת טיפול קו ראשון- ג'יין אפרלי
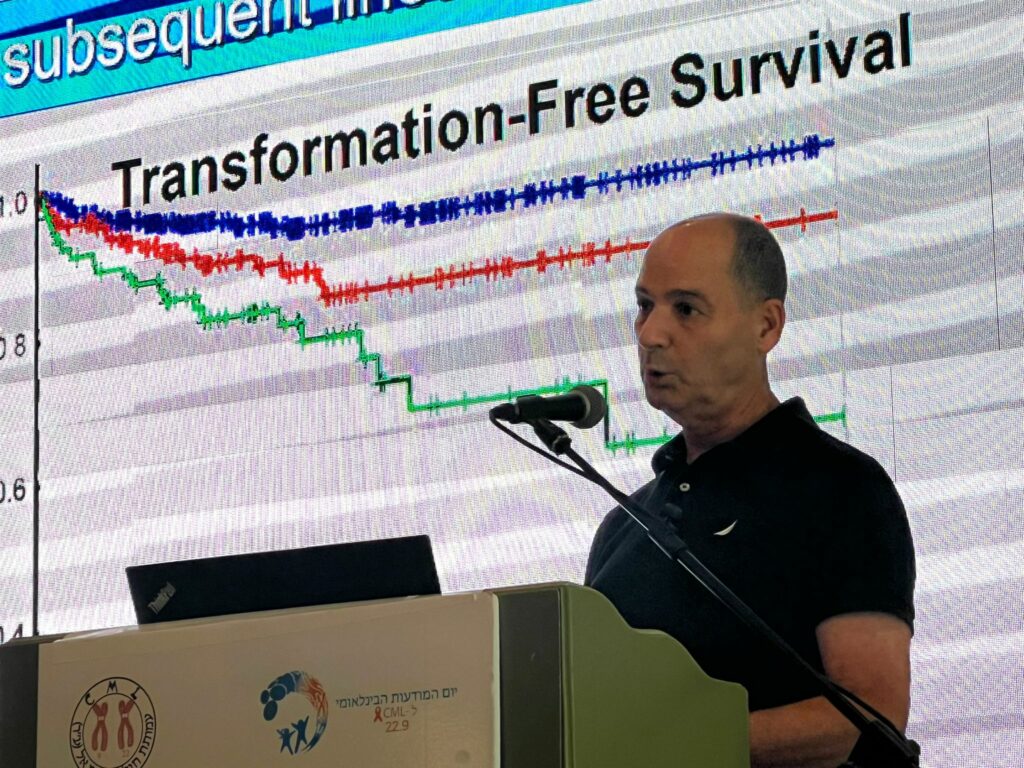
ג'יין אפרלי הדגישה שהשגת תגובה מולקולרית משמעותית (MMR) כבר אינה המטרה התרפויטית העיקרית. הבאת מטופלים לתגובה מולקולרית מלאה מורידה את הסיכון להישנות המחלה (לפי מחקר דסטיני הבריטי), וזאת משום שלא היו מקרים מדווחים על הישנות ב-MR4, למעט בקרב חולים בעלי דבקות טיפולית ירודה, או לאחר הורדה במינון בשל תופעות לוואי בלתי נסבלות.
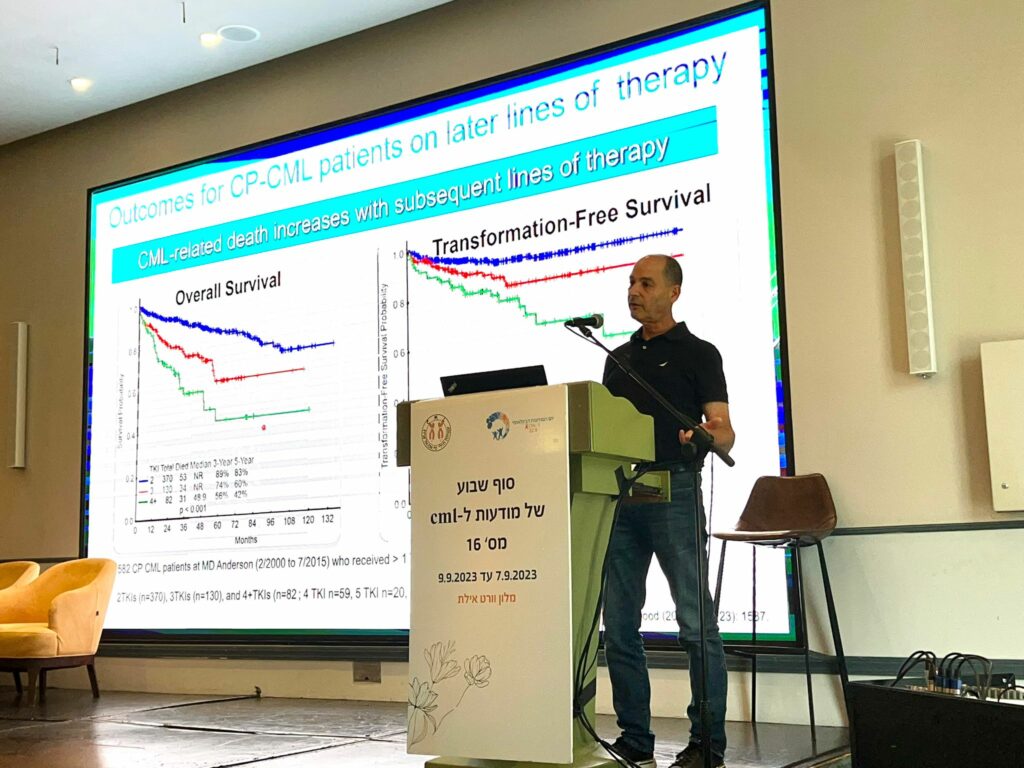
היא שאלה: אם כולנו מסכימים שתגובה מולקולרית מלאה היא מטרת הטיפול, איזה טיפול קו ראשון עלינו לבחור? סיכומי מחקרים על טיפולי קו ראשון באימטיניב, דסטיניב, נילוטיניב ובוסוטיניב הציגו שיעורי הישרדות של חולי CML והסתברות להשגת תגובה מולקולרית עמוקה דומים מאוד. למעשה, הסיבה הנפוצה ביותר למוות בקרב חולי CML אינה התקדמות המחלה, אלא מוות מתחלואה של מחלות אחרות.
אנו יודעים שלתרופות שונות יש תופעות לוואי שונות – נילוטיניב מעלה את הסיכון ללקות במחלות קרדיווסקולריות, דסטיניב גורמת לשליש מהחולים לפתח מים בריאות, ואימטיניב מעלה במעט את הסיכון לפרוגרסיה מוקדמת.
אפרלי הזכירה לקהל כמה קשה האיזון כשמנסים להשיג את הפגיעה הקטנה ביותר בחולה; שקילת תופעות הלוואי בשכיחות נמוכה יותר והעלות הנמוכה של אימטיניב מול שיעורי פרוגרסיה מופחתים, רמיסיות עמוקות יותר וסיכויים גבוהים יותר להפסקת טיפול עתידית, על ידי טיפול ב-TKI מהדור השני.
היא ציינה את האינדיקטורים הבאים הפועלים לטובת בחירה בטיפולי TKI מהדור השני כטיפולי קו ראשון:
• חולים בעלי סיכון גבוה במדד ELTS בזמן האבחון – ELTS הינו מדד סיכון חדש- EUTOS LONG TERM SCORE- (ציון סיכון גבוה של ELTS פירושו סיכוי של 11% לתמותה מ-CML, בעוד שבסיכון ELTS נמוך הסיכוי עומד על 2% בלבד) – ניתן למנוע את רוב הפרוגרסיות בסיכון גבוה על ידי שימוש ב-TKI דור שני.
• שינויים כרומוזומליים נוספים (כגון כרומוזום פילדלפיה נוסף, טריזומיה 8, איזוכרומוזום 17q וטריזומיה 19) והפרעות גנומיות נוספות.
• גיל צעיר יותר (ילדים ומבוגרים צעירים הם בעלי תגובות אטיות יותר ל-TKI בשלושת החודשים הראשונים לטיפול קו ראשון, ספירת תאי דם לבנים גבוהה יותר וטחול גדול יותר מאשר חולים מבוגרים יותר) – והרצון להרחבת משפחה, שיצדיק תגובה מהירה ועמוקה יותר ואפשרות להפסקת טיפול מהירה יותר בחולים אלו.
האינדיקטורים הבאים פועלים לטובת בחירה באימטיניב כטיפול קו ראשון:
• חולים בעלי סיכון נמוך במדד ELTS בעת האבחון.
• גיל מבוגר יותר (בנטילת דסטיניב, תפליט פלוראלי- מים בריאות נפוצים הרבה יותר בקרב חולים מבוגרים).
• מחלות לב וכלי דם (בנטילת נילוטיניב, תופעות הלוואי הקשורות למחלות לב וכלי דם מופיעות בשכיחות הרבה יותר גבוהה מאשר בנטילת אימטיניב עבור חולים בעלי גורמי סיכון למחלות לב וכלי דם, כגון לחץ דם גבוה, מחלות לב, ליפאז גבוה, סוכרת ויתר לחץ דם, שהם בבירור התווית נגד עבור נילוטיניב(.
כהנחיה כללית לבחירת TKI על בסיס מחלות רקע נלוות של המטופל, הציגה ג'יין אפרלי את המטריצה הבאה: (יש לזכור שבמדינות המערב יש היום 4 תרופות מאושרות כאופציה לקו ראשון- אימטיניב, נילוטיניב, דסטיניב וגם בוסוטיניב. בישראל הבוסוטיניב הוגש השנה לסל לקו ראשון אבל עדיין לא אושר)
תחלואות נלוות בוסוטיניב דסטיניב אימטיניב נילוטיניב
יתר לחץ דם
מחלת לב איסכמית
פקקת בעורק מוחי
מחלת עורקים היקפית פריפריאלית
תסמונת QT מוארך
אי ספיקת לב
סוכרת
דימום גסטרואינטסטינאלי
יתר לחץ דם ריאתי
מחלת ריאות כרונית
דלקת הלבלב
תפקוד כבד חריג
אין התווית נגד
סיכון נמוך להחמרה של מצבים קיימים קודמים
סיכון בינוני להחמרה של מצבים קיימים קודמים
להימנע אם ניתן
מעקב מולקולרי עם CML: כמה עמוק, באיזו תדירות וכיצד זה משפיע על הטיפול?- טים יוז
טים יוז התחיל את הרצאתו עם מצגת אודות כמה עמוק ובאיזו תדירות יש לבצע מעקב מולקולרי, וכיצד הבדיקות צריכות להשפיע על הטיפול.
לצורך המחשה, טים הדגיש את ציוני הדרך בטיפול כפי שהן מוגדרים בקווים המנחים העדכניים ביותר לטיפול בחולי CML ב- NCCNוב-ESMO.
ציוני דרך מוקדמים לתגובה לטיפול- מדריך ה- NCCN
מלבד זאת, הוא הציע להעריך את הגורמים הבאים לאחר שלושה חודשים בטיפול קו ראשון עם אימטיניב, על מנת להחליט אם להמשיך עם הטיפול הנוכחי או לעבור לטיפול אחרים:
החלפת טיפול דחייה המשך טיפול שיקול:
>10% יותר מ- % 10 <10%פחות מ- % 10 רמת תגובה מולקולרית
מינימלית/
ללא הפחתה הפחתה טובה מגמת התגובה מולקולרית
גבוהה נמוכה עדיפותTFR עתידית של החולה
גבוהה נמוכה רמת סיכון באבחון
אין כמה מחלות נלווית
גרועות טובות אי סבילות / תופעות לוואי
ללא כמה הפסקות טיפול
מבחינת תדירות מעקב PCR, טים הציע מעקב כל שלושה חודשים, למעט במצבים לא יציבים. אלו כוללים תגובה איטית (למשל, מדד BCR-ABL שנותר גבוה מ-10%), כשמדד BCR-ABL גבוה מ-0.1%, לאחר שהמטופלים ינסו הפסקת טיפול בתגובה מולקולארית עמוקה, או כשמתחילים שוב בטיפול לאחר ניסיון לא מוצלח להפסיק טיפול.
כאשר שוקלים הפסקת טיפול (TFR) בתגובה מולקולרית עמוקה ממושכת, יוז מזכיר שרמה מולקולרית ודינמיות המחלה, כמו גם עדיפות אינדיבידואלית מצד החולה להפסקת הטיפול, תחלואות נלוות ופרופיל סיכונים צריכים להילקח בחשבון.
הוא הציע להשתמש במטריציית ההנחיות הבאות כדי להעריך אם המטופל צריך להמשיך בטיפול או יכול להפסיקו:
הפסקת טיפול דחייה המשך טיפול שיקול:
3 שנים <יותר מ-3 שנים 3שנים <פחות מ-3 שנים משך 4 MR
4.5 MR 4 MR רמת תגובה מולקולרית
יציבה משתנה יציבות תגובה מולקולרית
גבוהה נמוכה דחיפות / מוטיבציה TFR
גרועה טובה סבילות הטיפול
כמה אין תחלואות נלוות
טובה גרועה הצמדות לטיפול
יחד עם זאת, יוז הדגיש את חשיבות דרישות סף מוסדיות, (שיש PCR בסטנדרד בינלאומי שמין ואיכותי), לוח זמנים קפדני למעקב בזמן הפסקת הטיפול ולאחר עלייה מולקולרית, ושימוש בקריטריונים לחידוש הטיפול לפי ההנחיות של NCCN ו-ESMO:
NCCN ESMO
דרישות מוסדיות דרישות מוסדיות
– IS סטנדרטי, בדיקת RQ-PCR עם רגישות זיהוי של לפחות MR 4.5 – IS סטנדרטי, מדויק, רגיש ל- RQ-PCR
<= קבלת תוצאות הבדיקה RQ-PCR תוך 2 שבועות לכל היותר <=קבלת תוצאות הבדיקה RQ-PCR תוך 4 שבועות לכל היותר
התייעצות עם מרכז המתמחה ב- CML ביצוע בדיקת RQ-PCR כל 4-6 שבועות אם יש צורך.
מעקב מובנה להתערבות מהירה במקרה של עלייה ברמות BCR-ABL1
קריטריון להתחלת טיפול נוסף
אבדן MMR
מעקב בזמן TFR מעקב בזמן TFR
-מדי חודש במשך השנה הראשונה
-מדי 6 שבועות בשנה השנייה
-מדי רבעון לאחר מכן (כשהמטופל נותר עם MMR)
-מדי חודש עבור כל 6 חודשים
-מדי 6 שבועות בחודשים 7-12
-כל רבעון לאחר מכן
אנחנו עדיין עושים השתלות במקרים של CML, נכון?
צ'רלס קרדוק מאוניברסיטת ברמינגהם הבריטית הביא זווית שונה והזכיר שעל אף כל ההתלהבות מ-TKI, שהשיג תוצאות מצוינות לטווח הארוך עבור רוב חולי CML, השתלת תאי גזע היא עדיין האופציה הטיפולית החשובה ביותר לאלה שעבורם טיפולי ה-TKI לא עוזרים, גם כיום.
במצגת שלו הוא הראה את השיפורים הגדולים בטכנולוגיית ההשתלות ואת הצמיחה בזמינות התורמים בשנים האחרונות, אשר הצליחו לשפר את התוצאות. למשל,
• שיפור בכמות התורמים במאגר (עם 30 מיליון מתנדבים הרשומים כיום במרשם התורמים הבינלאומי, בנוסף לתורמי דם טבורי), בטיפול תומך ובמניעת דחייה בתגובות שתל-מארח הפחיתו משמעותית את התמותה הקשורה להשתלות.
• עוצמת טיפולי כימותרפיה מופחתת מאפשרת כיום השתלה במבוגרים בכושר גופני טוב, אך גם גורמת לעלייה בסיכון להישנות המחלה, מה שדורש גישות חדשות למניעתה.
• פוטנציאל השתל נגד הלוקמיה ממונף בהשתלות אצל חולים בשלב כרוני ראשון. עירוי לימפוציטים של התורם (DLI) הוא טיפול יעיל בקרב חולים אלו, אך השפעות ה- DLI אינן טובות כאשר הן מיושמות בחולים בשלבי מחלה מתקדמים יותר.
על אף שזיהוי חולים שיכולים לעמוד בהשתלה השתפר, הישנות מחלה נותרה סיבה עיקרית לכישלון הטיפול, כך שעל מנת לשפר את תוצאות ההשתלה חייבים להתאים אסטרטגיות שונות, עם השתלות מתוחכמות יותר ומשטרי טיפול מותאמים אישית.
הבנה של אילו חולי CML ירוויחו מהשתלת תאי גזע הכרחית לקבלת התוצאות הטובות ביותר בטיפול ב-CML. בתור אבן בוחן לשקילת השתלת תאי גזע, קרדוק הדגיש את הקריטריונים הבאים, התלויים בשלב ה- CML:
לחולי CML בשלב כרוני:
• כישלון טיפול קו ראשון ב- TKI ותחזית לתגובה גרועה בטיפול קו שני ב-TKI
• כישלון להגיב לטיפולי קו ראשון וקו שני ב- TKI
• נוכחות מוטציה של T315I ו/או כישלון להגיב לפונטיניב
לחולי CML בשלב מואץ:
• חולים שלא טופלו כלל ב- TKI
• חולים שטופלו עם תגובה תת-אופטימלית ל-TKI
לחולי CML בשלב בלאסטי:
• חולים בשלב כרוני שני לאחר TKI או כימותרפיית הצלה
•
יישום נוסף של עירוי לימפוציטים של התורם מספק הפוגות מולקולריות ארוכות בקרב
30-90% מהחולים שעברו השתלה בשלב כרוני ראשון, כאשר סיבוכים בתגובות שתל-מארח נמוכים כש-DLI מיושם 12 חודשים לאחר ההשתלה או מאוחר יותר. מתן טיפול TKI לאחר ההשתלה יכול להביא לתגובה מולקולרית מלאה בקרב 60% מחולי CML הסובלים מהישנות – שוב, היעילות במיטבה כאשר ההשתלה מבוצעת בשלב כרוני ראשון.
לאלה שעוברים השתלה בשלב מתקדם של CML, פוטנציאל השתל מול הלוקמיה נראה נמוך, ומונותרפיה של TKI אינו מספיק לתת תגובות עמידות ארוכות ברוב החולים.
תוצאות השתלת מיח עצם בקרב חולי CML בשלב הבלאסטי עדיין גרועות למדי. עם TKI לבד, שיעורי ההישרדות לאחר חמש שנים עמדו על 10%, ואילו שילוב של TKI עם השתלה אלוגנאית העלה את שיעור השורדים לכ-47%. מכאן, אסטרטגיית הטיפול בשלב הבלאסטי היא להשיב את החולה לשלב כרוני שני על מנת שאז ניתן יהיה לבצע השתלה מרפאת. במשבר בלאסטי מיאלואידי, יוצע טיפול TKI המשולב עם טיפול כימותרפי. בחירת סוג ה-TKI ייעשה בהתחשבות בבדיקות מוטציות. במשבר בלאסטי לימפואידי, ייתכן שיומלץ משטר HyperCVAD משולב ב- אימטיניב או דסטיניב.
בשל העובדה שכ-30-70% מהחולים חווים הישנות של CML לאחר השתלה אלוגנאית, קרדוק מציע לחייב מעקב PCR אחת לשלושה חודשים בשלוש השנים הראשונות לאחר ההשתלה.
לסיכום, האסטרטגיה לשיפור תוצאות השתלה אלוגנאית בקרב חולי CML היא:
1. לצמצם את נטל המחלה טרם ההשתלה.
2. למטב את משטר הטיפול המכין לחולה.
3. למטב את פוטנציאל השתל לעומת הלוקמיה באמצעות צמצום דיכוי התגובה החיסונית לאחר ההשתלה, ולנהל את הישנות המחלה כדי לעכב את תופעות השתל מול הלוקמיה עד שהרעילות של ההשתלה תופחת.
4. ליישם טיפול הצלה יעיל באמצעות TKI ועירוי לימפוציטים של התורם.
ASH 2018
סיכום על CML מהמצגות בעל פה והפוסטרים
נכתב על ידי שרף גיורא
סאן דייגו- ארה"ב, דצמבר 2018
כל שנה במהלך השנים האחרונות אני נשאל על ידי חולים ורופאים המטולוגים, מה גורם לי לעזוב את הבית ל- 6 ימים ולטוס לצד השני של העולם לכנס ה- ASH בארה"ב, בעיקר כשנדמה ש- CML, המחלה שלי, הפכה להיות מחלה נשלטת ותוחלת החיים של חולה מטופל נכון, הנה כמו של אדם בריא. כשאני חושב על כך ישנן מספר תשובות. ראשית, ה- ASH הינו הכנס ההמטולוגי הגדול והחשוב ביותר של השנה כשהמידע החדש והמעודכן מכל המחקרים הקליניים האחרונים מוצג לראשונה באלפי מאמרים בעל פה ופוסטרים במהלך הכנס. שנית, מכיוון שהיום הנני מנהל גם את עמותת חליל האור, הבית של חולי סרטן הדם בישראל, אני חש שחובתי להיות נוכח במקום בו נוצרות תקוות חדשות לחולים במחלות המטו-אונקולוגיות כמו לימפומות או לוקמיות חריפות ולהעביר תקוות אלו לחולים בבית.
בנוסף הכנס הינו מקום למפגש עם רוב הנהלות החברות עימן אנו משתפים פעולה ברמה ארצית ורמה גלובלית ולדון בחיזוק שיתוף הפעולה והגברת שיתוף החולים בהליכים חשובים בתוך החברות.
כנס ה- ASH נפתח כל שנה ביום שישי עם סימפוזיונים רבים שממומנים על ידי חברות התרופות הגדולות עם מיטב הרופאים והמרצים. השנה לא התקיים סימפוזיון על CML כך שיכולתי להקדיש את הבוקר למפגש מעניין של נציגי עמותות חולים שמאורגן כל שנה על ידי חברת פייזר ולכנס ה- ICMLF שמובל על ידי דר טים יוז מאוסטרליה שמטרתו להגביר את הידע של רופאים במדינות עולם שלישי על CML והטיפול בחולים. המפגש שלהם השנה התמקד בהרצאה של דר דרגנה מילושביץ מהמרסמיט בלונדון על נושא הריון בחולי וחולות CML, ו- CML בילדים על יד דר סוטורפ מגרמניה. בהמשך הציגה דר בנה מגאנה על האתגרים בניהול חולי CML בארצה.
מבחינת הרצאות על CML הכנס כלל: מושב חינוכי מרכזי על CML, 3 מושבי הצגות בעל פה בכל מושב 6 מצגות, ומושבי הפוסטרים בסיומו של כל יום.
הדו"ח הזה מסכם את הנושאים העיקרים והמעניינים שמצאתי במושבי הפוסטר והמצגות בעל פה. הנושאים כוללים הפסקת טיפול, הריון ותכנון משפחה ב- CML ותרופות חדשות בפיתוח ל- CML. מתחת לכל סיכום אפשר למצוא את הקישור שמוביל למאמר עצמו.
תרופות חדשות לטיפול ב- CML – האם ניתן לשפר את עתיד החולים?
בוועידת ASH 2018 השנתית שמענו סיכומים אודות ארבע תרופות חדשות לטיפול ב-CML. רק אחת מהן פותחה ע"י חברת פארמה גלובלית גדולה ושלוש האחרות פותחו ע"י חברות ביוטק קטנות יותר בדרום קוריאה, רוסיה וסין. באופן מעניין, שלוש מתוך ארבע התרופות הראו יעילות כנגד המוטציה T315I ולפחות שתיים מהן תוכננו במיוחד להתמקד במוטציה זו.
ראדוטיניב מדרום קוריאה – הוצגה כפוסטר
https://ash.confex.com/ash/2018/webprogram/Paper110568.html
ראדוטיניב (INN; שם מסחרי ספקט), היא תרופה לטיפול ב-CML שפותחה ע"י חברת Ilyang Pharmaceutical הדרום קוריאנית. המפרסמים סיכמו את התוצאות מארבע השנים שעברו מאז הניסוי הקליני בשלב שלישי עבור חולי CML בדרום קוריאה שאובחנו לאחרונה. הניסוי ערך השוואה בין נטילת 300 מ"ג ראדוטיניב פעמיים ביום לבין נטילת 400 מ"ג ראדוטיניב פעם ביום. התגובות לראדוטיניב היו עמוקות ומהירות יותר בהשוואה לקבוצה שנטלה אימטיניב. לאחר ארבע שנים, 76% מהחולים שנטלו ראדוטיניב השיגו MMR מול 56% בלבד בקרב אלה שנטלו אימטיניב. 46% השיגו 4.5MR בנטילת ראדוטיניב לעומת 33% מאלה שנטלו אימטיניב. עם זאת, בין שתי הקבוצות לא היה הבדל בשיעור ההישרדות הכללי או ה-PFS.
לא דווחו כל בעיות בטיחות חדשות בנטילת רדוטיניב, במיוחד בנוגע לאירועים הקשורים במחלות לב וכלי דם. המאמר סיכם שראדוטיניב עשויה להביא לאפשרות גבוהה יותר של הפוגה ללא טיפול (TFR) לאחר טיפול קו ראשון, וכי היא יכולה להפוך אחת מאופציות הטיפול לאחר אבחון ב- CML-CP. מעניין היה לשמוע ממומחי CML שנכחו במקום שעל אף שלראדוטיניב יעילות דומה לזו שמציע טיפול TKI דור שני ועל אף שהיא זולה יותר, הם לא סבורים שהיא תשווק מחוץ לדרום קוריאה והמדינות השכנות לה.
PF-114 מרוסיה – הוצגה בעל פה
https://ash.confex.com/ash/2018/webprogram/Paper116803.html
PF-114 היא תרופה מסוג TKI דור רביעי עם מבנה הדומה לזה של פונטיניב. היא נועדה למנוע עיכוב של מספר קינאזות חריגות ובכך להפחית תופעות לוואי מסכנות חיים. השלב הראשון בניסוי גייס 51 חולי CML שעברו לפחות שני טיפולי TKI כושלים. הניסוי בחן רמות עולות של 50-750 מ"ג, כאשר המינון המרבי הנסבל היה 600 מ"ג בנטילה דרך הפה פעם ביום. יחס יעילות/בטיחות אופטימלי נמצא במינונים של 200 ו-300 מ"ג. תופעת הלוואי העיקרית הייתה פצעים דמויי פסוריאזיס על העור. התרופה הוכיחה יעילות נגד מוטציית T315I ללא רעילות לב וכלי דם. מחקר שלב שני רב מרכזי ובינלאומי מתוכנן לשנת 2019.
HQP1351 מסין – הוצגה בעל פה
https://ash.confex.com/ash/2018/webprogram/Paper119142.html
. את התרופה הציגה ד"ר קיאן ציאנג מסין, שתנאם גם בוועידת CML Horizons 2019 שתיערך בקניה. HQP1351 הוא מעכב פעיל חזק לנטילה אוראלית הפועל נגד מוטציות רבות, כולל T315I. השלב הראשון בניסוי כלל העלאה במינון יחיד לחולי CML שנמצאו עמידים בפני טיפולי TKI, בשלבים כרוניים (58 מטופלים) או מואצים (12 מטופלים), ושמעולם לא טופלו באמצעות פונטיניב. המינון המרבי הנסבל עמד על 50 מ"ג. התרופה הייתה נסבלת בהחלט ופעילה ביותר בקרב חולי CML, כולל אלו בעלי מוטציית T315I. בחציון מעקב עד 7 חודשים, 96% ממטופלי CP ו -85% ממטופלי AP השיגו תגובה המטולוגית מלאה, ובאופן מעניין למדי, המטופלים בעלי מוטציות T315I השיגו תגובות טובות יותר. הרעילות העיקרית הייתה טרומבוציטופניה ופיגמנטציה בעור.
אסימיניב של נוברטיס – הוצגה בעל פה
https://ash.confex.com/ash/2018/webprogram/Paper113609.html
מאחר שמוטציית T315I עמידה בפני כל טיפולי TKI הזמינים, למעט פונטיניב אשר מזוהה עם רעילות לב וכלי דם, נדרשות אפשרויות טיפול נוספות. אסימיניב שונה מטיפולי TKI אחרים, משום שהיא לא נקשרת דרך ה-ATP והראתה פעילות נגד BCR-ABL שעברו מוטציות או לא, כולל T315I במחקרים קליניים. 32 חולי CML בעלי מוטציית T315I גויסו לשלב ראשון בניסוי. לאחר 15 חודשים כמעט 37% מהם השיגו MMR ו-20% MR4.5. המינון ליעילות אופטימלית היה 200 מ"ג פעמיים ביום. טיפול בלעדי באסימיניב הציג יעילות מבטיחה ופרופיל בטיחות מועדף בחולים בעלי מוטציית T315I ב-CP וב-AP. תופעות הלוואי השכיחות ביותר בקבוצת הנחקרים היו כאבי מפרקים, עייפות, עלייה ברמת הליפאז ובחילות. החוקרים סיכמו שהתרופה מסוגלת להוות אפשרות טיפול חדשה לחולי CML בעלי מוטציית T315I שפונטיניב אינה מתאימה להם או שהטיפול בתרופה זו לא צלח. ניסוי זה עדיין בשלבי גיוס נבדקים.
הפסקת טיפול בחולי CML – סיכומים נבחרים וממצאים
היתכנות של הפסקת הטיפול ב-CML בעולם הרפואה בספרד: תוצאות מסדרה ארצית של 236 חולים – מצגת בעל פה
https://ash.confex.com/ash/2018/webprogram/Paper109976.html
זה היה סיכום מעניין כיוון שבפעם הראשונה הציגו ממצאים מהחיים עצמם בספרד בנוגע לתוצאות הפסקת טיפול בקרב 236 חולי CML מחוץ לניסויים קליניים. הגיל הממוצע של החולים בעת האבחון היה 50 ו-61 בזמן הפסקת הטיפול, כלומר רובם עברו טיפול במשך שנים רבות. 78% מהם עברו TKI דור ראשון, 14% TKI דור שני ו-8% TKI דור שלישי. 74% נטלו אימטיניב כשהפסיקו את הטיפול, 18% נילוטיניב, 7% דסטיניב וכמה מטופלים בודדים נטלו פונטיניב ובוסוטיניב. ארבע שנים לאחר הפסקת הטיפול, 64% מהם היו עדיין על TFR, גבוה יותר מהמספר שראינו בניסויים הקליניים על TFR. ההישנות האחרונה אירעה 30 חודשים לאחר הפסקת הטיפול. משך טיפול TKI של פחות מחמש שנים ו-RM4.5 קצר יותר מארבע שנים לפני הפסקת TKI היו קשורים באופן משמעותי עם שכיחות גבוהה יותר של הישנות מולקולרית. החוקרים המליצו לשים לב בעיקר לעלייה ברמת הכולסטרול לאחר הפסקה בנטילת אימטיניב.
השהיית טיפול באימטיניב ואימות (ISAV) מחקר: תוצאות סופיות לאחר 79 חודשים – הוצג בעל פה
https://ash.confex.com/ash/2018/webprogram/Paper112982.html
מחקר רב-מרכזי בינלאומי זה על הפסקת טיפול אימטיניב בחולי CML גייס 112 מטופלים. PCR דיגיטלי נערך בתחילת המחקר ועוד אחד במהלכו. התוצאות לאחר 79 חודשים הוצגו – הממצא העיקרי היה שמעקב לטווח ארוך הכרחי, כיוון שהישנות מאוחרת מתרחשת גם בשנה הרביעית לאחר הפסקת הטיפול. באופן מעניין, מטופלים בני פחות מ-45 התגלו בעלי סיכון גבוה יותר להישנות.
ניסיון שני להפסקת הטיפול ב-TKI עם דסטיניב לצורך הפוגה ללא טיפולים לאחר כישלון הניסיון הראשון עם אימטיניב: הפוגה ללא טיפולים הושלמה עם (TRAD) מחקר דסטיניב – הוצג בעל פה
https://ash.confex.com/ash/2018/webprogram/Paper114656.html
תוצאות מעניינות אבל ראשוניות למדי מגיעות ממחקר קנדי שבחן ניסיון להפסיק בפעם השנייה טיפול בדסטיניב בקרב 131 חולים שלא הצליחו להפסיק טיפול באימטיניב. המחקר נועד לגלות אם ניתן לשפר TFR2 באמצעות TKI מדור שני לאחר כישלון ראשון עם אימטיניב. עד כה, הפסיקו את הטיפול 25 מטופלים שקיבלו דסטיניב והגיעו ל- MR4.5במשך 12 חודשים. 21 מהם איבדו תגובה מולקולרית לאחר 3.7 חודשים. המחקר עדיין לא אישר שדסטיניב יכולה לשפר את מדד ה- TFR2לאחר שנכשלת הפסקת טיפול באימטיניב. יש צורך לדון ולראות אם נדרשות אמות מידה נוקשות יותר ל-TFR2, כמו תגובה מולקולרית עמוקה יותר של MR5.5 או זמן ארוך יותר לתגובה מולקולרית עמוקה מאשר שנה, כפי שנעשה במחקר.
מעקב ארוך טווח לאחר הפסקת הטיפול בחולי CML: מחקר קוריאני על הפסקת טיפול באימטיניב (KID) – הוצג כפוסטר
https://ash.confex.com/ash/2018/webprogram/Paper118026.html
מחקר זה מקוריאה גייס 126 מטופלים שנטלו אימטיניב לפחות שלוש שנים ועברו לפחות שנתיים של PCR בלתי ניתן לגילוי. לאחר מעקב חציוני של 43 חודשים, 55 מטופלים (44%) איבדו MMR. מתוך 53 מטופלים שהמשיכו ליטול אימטיניב, 51 השיגו שוב MMR. עם זאת, בניסוי היה לפחות מקרה אחד של מטופל שנטל אימטיניב במשך עשר שנים ועבר שנתיים וחצי של PCR בלתי ניתן לגילוי מתמשך לפני שהפסיק. הוא חווה הישנות 53 חודשים לאחר הפסקת הטיפול, השיב MMR במהירות, אך שישה חודשים לאחר שהתחיל את הטיפול בשנית סבל ממשבר בלאסטי. אנו יודעים שזהו מקרה נדיר ביותר מתוך 2,000 מטופלים שהפסיקו את הטיפול בניסוי הקליני. על אף שדווח בעבר על משבר בלאסטי פתאומי שהתרחש בחולי CML מגיבים בעת הטיפול באימטיניב, יש להתייחס בזהירות לאירוע של פרוגרסיה ל-BC בניסוי קליני להפסקת טיפול באימטיניב.
היריון ו-CML
מחקר שלGimema בנושא עיבור/היריון בחולות CML איטלקיות בוגרות: תוצאות 166 מקרים – הוצג בעל פה
https://ash.confex.com/ash/2018/webprogram/Paper118908.html
עקב מחסור בנתונים בנושא עיבור בחולי CML והיריון בחולות CML בזמן טיפולי TKI שונים, האגודה האיטלקית ל-CML, Gimema, החלה ב-2013 במחקר רטרוספקטיבי\פרוספקטיבי שמטרתו הייתה לתאר את תוצאות המעקב אחר חולים אלו. השאלות שהופנו נגעו להיריון, לטיפול ב-CML ולמצב התינוק. תשובותיהם של 137 מטופלים נותחו, 83 גברים ו-54 נשים. היו 168 מקרי היריון/התעברות (106 גברים, 62 נשים). בקרב חמש נשים המחלה אובחנה בזמן ההיריון. שתיים מהן בחרו לעשות הפלה, אחת טופלה באינטרפרון ושתיים אחרות היו במעקב בלבד. שלושת התינוקות נולדו בניתוח קיסרי. כל הנשים שנכנסו להיריון הפסיקו את טיפולי ה-TKI. כל החולים שאיבדו תגובה כתוצאה מהפסקת טיפול TKI והתחילו שוב בטיפול, חזרו להפוגה. המסקנות העיקריות עד עתה הן שזה אפשרי לגברים ונשים חולי CML לתכנן ולהיכנס בהצלחה להיריון. יש חשש קטן ביותר בנוגע לפוריות, התעברות ולידה של בנות זוג של חולי CML, ואילו חולות במחלה צריכות להפסיק את טיפולי ה-TKI עם קבלת תוצאה ראשונה על היריון. אין לערוך שום טיפול עד לשבוע 13-15 להיריון. לאחר תקופה זו ולאחר שהשלייה נוצרת, ניתן לשקול טיפול TKI בעל יכולת חדירה נמוכה לשלייה (אימטיניב או נילוטיניב) ולהתחיל באינטרפרון. תינוקות שנולדו לחולי CML לא מציגים מאפיינים שונים מקבוצות דומות באוכלוסייה.
קינטיקה של שיבוט לוקמי בחולי CML במהלך הריון- הוצג כפוסטר
https://ash.confex.com/ash/2018/webprogram/Paper115984.html
אחד האתגרים הגדולים בטיפול בחולות CML צעירות הוא הצורך להפסיק את טיפול ה-TKI בזמן ההיריון. יש בעיות רבות הקשורות לכך, כולל איזו רמת תגובה נדרשת לפני שהן מפסיקות את הטיפול והקצב שבו הן שבות ל-MR לאחר תחילת הטיפול בשנית. עבודה חשובה זו, בהובלת מומחיות CML כמו ג'יין אפרלי ואקטרינה צ'לישבה, נעשתה על מנת לנתח אובדן והתאוששות תגובה מולקולרית בחולות CML בעלות תגובה מולקולרית משמעותית התחלתית(MMR) ותגובה מולקולרית עמוקה (DMR) אשר הפסיקו את ה-TKI במהלך ההיריון. נתונים נאספו ממרשם ההיריון הרוסי וממאגרי מידע נוספים. 87 מקרים נמצאו מתאימים לניתוח והם חולקו לשלוש קבוצות: 39 בעלות תגובה מולקולרית עמוקה וקריטריונים להפסיק, 26 בעלות DMR אבל ללא קריטריונים להפסיק ו-22 בעלות MMR בלבד. החוקרות סיכמו שחולות CML בעלות DMR וקריטריונים להפסיק הן בעלות הסיכויים הגבוהים ביותר לשמור על MMR בזמן ההיריון לאחר הפסקת TKI, ויכולות להישאר ללא טיפול לאחר הלידה. MMR אובד ברוב החולות בעלות MMR/DMR ואינו בעל קריטריון להפסיק. עם זאת, אובדן התגובה הוא הפיך ו-MMR ניתן להשבה בתוך שנה עד שנתיים לאחר חידוש טיפולי TKI, למרות אבדן MR2.
הנתונים אישרו את האפשרות לתכנון היריון לא רק בחולות CML בעלות DMR יציב, אלא גם בחולים בעלי MMR בלבד או DMR בלתי יציב לצד מעקב מולקולרי זהיר בזמן ההיריון ואחריו.
תוצאות היריון בקרב חולות שטופלו בבוסוטיניב – הוצג כפוסטר
https://ash.confex.com/ash/2018/webprogram/Paper110547.html
לראשונה בוועידת ASH ראיתי קונספט חדש של כתיבת חלק מהמידע המחקרי בשפה ידידותית למטופלים. הנה קישור לעבודה נהדרת כזאת
Effects on pregnancy if a mother or father have taken bosutinib
סיכום זה חקר את תוצאות טיפול בבוסוטיניב בזמן היריון. הניסוי כלל 33 מקרים, 17 גברים ו-16 נשים. המחקר מתאר מה קרה במגוון הריונות כשהאב או האם טופלו בבוסוטיניב. מתוך 16 הריונות נולדו חמישה תינוקות בריאים, שתי נשים בחרו לבצע הפלות, שני תינוקות מתו בטרם הלידה ואין בנמצא תוצאות משבעת ההריונות האחרים. מתוך 17 הריונות שבהם האב חולה נולדו תשעה תינוקות בריאים, ארבע בחרו לבצע הפלות, תינוק אחד מת בטרם הלידה ואין בנמצא תוצאות משלושת ההריונות האחרים. על אף שהמחקר לא מצא בעיות בטיחות בהריונות על רקע נטילת בוסוטיניב, החוקרים מסכמים שהתרופה לא מומלצת לשימוש בזמן ההיריון, וכי מומלץ למטופלים בה להשתמש באמצעי מניעה יעילים לאורך הטיפול.
ההרצאות והמצגות של הכנס השנתי 2018
הכנס השנתי של מודעות ל- CML של שנת 2018, התקיים בתאריכים 4-6 לאוקטובר בבית מלון רמדה בחדרה, בנוכחות 250 משתתפים כולל מרצים מומחים מהארץ ומחו"ל.
אנחנו שמחים להביא את ההרצאות המרתקות בוידאו משולבות בשקפים של כל הרצאה, וגם את המצגות שניתנות להורדה בנפרד.
זו הזדמנות פז לכל מי שלא הצליח להשתתף לשמוע ולראות את כל ההרצאות של יום חמישי ושישי.
יום חמישי 4.10.2018
להבין CML- מה שכל חולה חייב לדעת- דר אריאל אביב מנהל המחלקה ההמטולוגית בבית חולים העמק- לצפייה. למצגת
מה זה? כל אחד נהייה לי פרופסור?- סיגל שפרן תקוה ולילי פרלמן- לצפייה. למצגת
בעיות ואתגרים של חולי CML
עמידות לטיפול- מה עושים ומתי? פרופ' פיה רענני- מנהלת המחלקה ההמטולוגית בבית חולים בילינסון- לצפייה. למצגת
התאמת מינון של TKI- למה אין קווים מנחים- פרופ' אנדראס הוכהאוס- מנהל המחלקה בבית חולים יינה- לצפייה. למצגת
פרספקטיבת החולים על CML בשנת – אתגרים-2018- שרונס נרבוטס- מנהל עמותת החולים בליטא- לצפייה. למצגת
ניטור ומעקב של CML
RT-PCR- למה? כמה? בדיקת מוטציות- דר' טלי תוהמי- מנהלת המעבדה המולקולרית בית חולים מאיר- לצפייה. למצגת
PCR דיגיטלי, NGS, PCR ג'נומי- בדיקות מתקדמות וההשלכה על החלטות טיפוליות- פרופ הוכהאוס- לצפייה. למצגת
הרצאה לקבוצת הצעירים-
הריון ו- CML- איך עושים זאת נכון? – דר אלכס גורל- בית חולים הדסה עין כרם- לצפייה. למצגת
בחירת טיפול קו ראשון והצמדות לטיפול בחולים צעירים- פרופ' רענני- לצפייה. למצגת
ארגון מנהיגי סרטן צעירים באירופה- מה שונה?- שרונס נרבוטס :- לצפייה. למצגת
יום שישי 5.10.2018
יחסי רופא מטופל בעידן הדיגיטלי
סרטון בהפקת בית חולים הדסה על העתיד בתקשורת רופא-מטופל- לצפייה.
תפקיד הרופא בעידן הדיגיטלי החדש- פרופ' דינה בן יהודה- מנהלת המחלקה ההמטולוגית בית חולים הדסה- לצפייה. למצגת
משחק תפקידים רופא? חולה?- פרופ' דינה בן יהודה ושרף גיורא-כולל דיון בפאנל- גיא תבורי, פרופ פיה רענני לצפייה.
דר' יאיר בר דוד, בהנחיית סיגל שפרן תקווה ולילי פרלמן-
העתיד ב- CML- האם הוא כבר כאן?
האם אפשרי להגיע לריפוי ב- CML?- פרופ' דינה בן יהודה- לצפייה. למצגת
ניסויים קליניים בתרופות חדשות- הטייגר בגרמניה, שילובים, טסימיניב- ABL- פרופ' הוכהאוס- לצפייה. למצגת
טיפול מותאם אישית ב- CML- מהתאוריה למציאות- פרופ' פיה רענני- לצפייה. למצגת
הפסקת טיפול לחולי CML
ההנחיות להפסקת טיפול-NCCN, ESMO- דר' מיה קורן מיכוביץ- מנהלת המחלקה ההמטולוגית באסף הרופא- לצפייה. למצגת
דיבייט- האם הפסקת טיפול צריכה להיות מטרה ראשונית כבר באבחון חולה חדש?
כן, בוודאי- פרופ' הוכהאוס- לצפייה. למצגת
לא- יש מטרות חשובות יותר- דר' נועם בניימיני- בית חולים איכילוב- לצפייה. למצגת
פרספקטיבת החולים בהפסקת טיפול- תוצאות ראשונות מהסקר הבינלאומי שערכנו- גיורא שרף- לא צולם למצגת
הכנס השנתי של מודעות ל- CML של שנת 2017, התקיים בתאריכים 7-9 לספטמבר בבית מלון אסיינדה ביער במעלות, בנוכחות 250 משתתפים כולל מרצים מומחים מהארץ ומחו"ל.
אנחנו שמחים להביא את ההרצאות המרתקות בוידאו משולבות בשקפים של כל הרצאה, וגם את המצגות שניתנות להורדה בנפרד.
זו הזדמנות פז לכל מי שלא הצליח להשתתף לשמוע ולראות את כל ההרצאות של יום חמישי ושישי.
יום חמישי 7.9.2017
מבוא ל- CML- הבנת המחלה והמושגים- משחק חידון עם יו"ר וועד העמותה דר יאיר בר דוד ותמי קימלמן: לצפייה.
תזונה נכונה לחולי סרטן- פנינה בר סלע דר' לתזונה: לצפייה. למצגת
דיבייט- טיפול קו ראשון בחולה חדש- מה צריכה להיות האופציה המועדפת?
האופציה המועדפת היא גליבק- או אימטיניב גנרי- דר נועם בניימיני- בית חולים רמבם: לא צולם למצגת
האופציה המועדפת הן תרופות הדור השני דסטיניב ונילוטיניב- דר' יוליה וולצ'ק- בית חולים שיבא: לא צולם למצגת
הרצאה לקבוצת הצעירים
הריון ו- CML- איך עושים זאת נכון? דר' עדי שחם אבולעפיה מבילינסון : לצפייה. למצגת
הריון ו-CML- איך עושים זאת באנגליה- דר' דרגנה מילושביץ- בי"ח המרסמיט לונדון : לצפייה. למצגת
בעיות ואתגרים של חולי CML
עמידות לטיפול- מה עושים?- דר ילנה מישצ'נקו בית חולים בני ציון חיפה: לצפייה. למצגת
תופעות לוואי לטיפולים ולמחלה- איך עוזרים? דר' דרגנה מילושביץ מלונדון: לצפייה. למצגת
תופעות לוואי קרדיו-וסקולריות של תרופות TKI מדור שני- דר' יוליה וולצ'ק מבית חולים שיבא-: לצפייה. למצגת
שיתוף פעולה בניטור חולי CML של המטולוג וקרדיולוג- דר' זאזא יעקובישוילי- בית חולים בילינסון- לצפייה. למצגת
יום שישי 8.9.2017
משפחתי והתמודדות עם מערכת הבריאות- דר' סיגל שפרן תקוה ולילי פרלמן- לא צולם למצגת
הרצאה מקבילה לצעירים- קנאביס רפואי- למי מתאים? מתי? ואיך מקבלים?
קנאביס ותופעות לוואי אצל מטופלי CML- דר' ג'והני גרינפלד- מנהל מרפאת כאב באסף הרופא- לא צולם למצגת
דר' איליה רזניק- שימוש בקנאביס רפואי- לא צולם למצגת
קנאביס בשימוש רפואי- אין עשן בלי אש- דר' אריאל אביב- מנהל המחלקה ההמטולוגית בית חולים העמק: לא צולם למצגת
תרופות גנריות ל- CML
מה הניסיון בארץ ובעולם בשימוש בגנריקה ל- CML? דר מיה קורן מיכוביץ, בית חולים אסף הרופא- – לצפייה. למצגת
פרספקטיבת החולים לגבי תרופות גנריות ל- CML- שרף גיורא- מנהל העמותה- לצפייה. למצגת
הפסקת טיפול ב- CML
דיבייט- האם הפסקת טיפול יכולה להעשות מחוץ למסגרת של ניסויים קליניים
כן, בוודאי- וגם הורדת מינון אפשרית מידע מניסוי הדסטיני באנגליה- דר' דרגנה מילושביץ-המרסמיט: לצפייה. למצגת
לא- דר' מיה קורן מיכוביץ בית חולים אסף הרופא – לצפייה. למצגת
פרספקטיבת החולים בהפסקת טיפול- גיורא שרף- מנהל העמותה- לצפייה למצגת
ASH 2017- סיכום הרצאת האידוקשיונל על CML
נכתב על ידי שרף גיורא ויאן גייסלר- CML ADVOCATES NETWORK
כתבה זו מסכמת את 3 ההרצאות שהוצגו במושב האדיוקשיונל על CML בכנס ה- ASH האחרון באטלנטה.
במושב האדיוקשיונל על CML , שלושת הנושאים שנבחרו השנה היו: הפסקת טיפול ב-CML, בעיות קרדיו-וסקולריות של לב וכלי דם כתוצאה משימוש בתרופות למחלה והדרך לנסות לחסל את תאי האב הלוקמיים במוח העצם שתרופות ה- TKI שאנחנו לוקחים אינן מצליחות לחסל, ואולי אם נצליח לחסלם נגדיל את הסיכוי להשגת ריפוי למחלה.
פרנסואה מהון, מומחה CML מצרפת שהיה הראשון להתחיל את הניסויים בהפסקת טיפול בחולי CML בניסוי ה- STIM לפני יותר מ- 10 שנים ל-100 חולים, סיכם את הידע מהמחקרים שנערכו עד היום על הפסקת טיפול ביותר מ-2500 חולי CML בכל רחבי העולם.
סיבות עיקריות להפסיק טיפול כוללות תכנון המשפחה והיריון, הימנעות מעיכוב צמיחת הגוף של ילדים בטיפול ב- TKI, העדפות המטופל על איכות החיים והימנעות מתופעות לוואי ארוכות טווח, כמו גם סיבות כספיות (עלויות התרופה משמעותיות בטיפול לכל החיים).
פרנסואה מהון פתח את ההרצאה על ידי הצגת התוצאות של המחקר הראשון בהפסקת טיפול בחולי CML , STIM, אשר כלל מעקב של 8 שנים. בסך הכל, יותר מ 2500 חולי CML הפסיקו טיפול בניסויים קליניים עד כה. לאחר מכן הוא סיכם מטא-אנליזה של 509 מטופלים ב -15 מחקרי הפסקת טיפול שפורסמו בכתב העת EJC לאחרונה, אשר גילתה כי שיעור ההישנות המולקולארית הממוצע של החולים שהפסיקו טיפול, היה 51% – כך שכמחצית מהחולים יכולים להפסיק את הטיפול בבטחה, בעוד מחציתם נזקקו לטיפול חוזר. הצורך לחזור לטיפול קרה אצל ארבעה מתוך חמישה חולים במהלך 6 החודשים הראשונים, כך שברוב החולים, הישנות ה- CML מתרחשת במהירות לאחר הפסקה – אך לא אצל כול המטופלים. אצל חלקם יש הישנות מאוחרת יותר, דבר שמדגיש את הצורך בניטור קפדני תמידי. רק חולה אחד ב -15 המחקרים הללו התקדם למשבר בלאסטי.
מחקרי הפסקת טיפול אחרי טיפול בתרופות הדור השני, כמו אנסט סטופ ואנסט פרידום עם נילוטיניב ודספרי עם דסטיניב, הראה שיעורי הישנות דומים לאלו אחרי אימטיניב, למרות ששיעור החולים שהשיגו תגובה מולקולארית עמוקה היה גבוה יותר בקרב אלו הנוטלים תרופות דור שני. נראה שלמשך הזמן של התגובה המולקולארית העמוקה לפני הפסקת טיפול, יש השפעה רבה על ההצלחה של הפסקת טיפול. מעניין לציין, כי מחקר הפסקת הטיפול הגדול ביותר עד כה, היורו סקי, עם כ -800 חולים שגויסו, הראה גם הישנות מאוחרת לאחר 30 חודשים, מה שמחייב בדיקות PCR גם שנים רבות לאחר הפסקת טיפול. תסמונת גמילה מ-TKI (כאבי שרירים, כאבי מפרקים,) בחולים נצפית לעיתים קרובות, אך לרוב נמשכת תקופה קצרה.
הנחיות רשמיות לרופאים על מתי להפסיק טיפול עדיין חסרות, למעט קווים מנחים של ה- NCCN האמריקאי. הנחיות ה-ELN נמצאות כעת בעדכון ויכללו המלצות לדרישות המוסדיות שיאפשרו הפסקה בטוחה של הטיפול, אך המלצות אלו טרם פורסמו.
המלצות קבוצת ה- CML הצרפתית על הפסקת טיפול מחוץ לניסויים קליניים.
ד"ר מהון הציג את ההנחיות של קבוצת המומחים ל- CML הצרפתית FILMC על הפסקת הטיפול בחולים עם תגובה מולקולארית עמוקה מחוץ למחקרים קליניים.
ד"ר מהון סיכם כי הפסקת הטיפול ב- TKIמבוצעת יותר ויותר בחולי CML הנמצאים בתגובה מולקולארית עמוקה מחוץ למסגרת של ניסויים קליניים. מחקרים רבים שנערכו עם יותר מ -2500 חולי CML עם תגובה מולקולארית עמוקה מתמשכת הראו שכמחצית מהחולים נשארים במצב של רמיסיה במשך שנים עם הפסקת הטיפול ב- TKI. נראה שכמעט כל המטופלים הזקוקים לחידוש הטיפול מצליחים להשיג שוב את התגובה העמוקה.
לאחר ההרצאה שאל גיורא שרף את דר מהון לגבי חולים שמאבדים את התגובה המולקולארית לאחר שנים של הפסקת טיפול. מקרים אלו אינם מתוארים בדרך כלל בסיכומים שמוצגים. דר מהון הודה שאכן יש מעט מקרים בודדים של חולים שמאבדים תגובה וחוזרים לטיפול לאחר שנים של הפסקת טיפול, וזה דומה למה שקורה עם חולים שעברו השתלת מיח עצם והמחלה חוזרת אחרי הרבה שנים. זה מדגיש שוב את העובדה שהפסקת טיפול אינה יכולה להיחשב כריפוי וחייבים להדגיש למטופלים את חשיבות המשך הניטור ובדיקות ה- PCR לאורך שנים רבות.
גיורא שואל את מהון- תודה לדר ילנה מישצ'נקו על התמונה
ההרצאה השנייה הייתה ד"ר ג'ויד מוסלחי ודנה בתופעות הלוואי של טיפולי TKI הנוכחיים, תוך התמקדות בבעיות לב וכלי דם. הוא סקר את מה שידוע כיום על ההשפעה של TKIs על מערכת הלב וכלי הדם ודן במנגנונים פוטנציאליים היכולים לגרום לבעיות הקרדיו-וסקולאריות. הוא ציין כי נילוטיניב הראה תגובות מולקולאריות טובות ומהירות יותר מאשר אימטיניב, אך לא הצליח להוכיח שיפור של הישרדות כוללת. דסטיניב, עם יעילות דומה לנילוטיניב, הראה עלייה בלחץ דם ריאתי, בעוד נילוטיניב הראה עלייה באירועים קרדיו וסקולריים ורמת גלוקוז מוגברת. הסיבות מדוע זה קורה עדיין לא ברורות לגמרי. הוא גם הסביר את מה שקרה עם פונטיניב בשנת 2013 כשתופעות לוואי של בעיות לב וכלי דם במטופלים בפונטיניב הובילו את ה- FDA להגביל את התווית התרופה, אבל גם כאן המנגנונים שגורמים לתופעות אלו, עדיין אינם ברורים גם כן. ד"ר מוסלחי הציע כי בדיוק כמו שרפואה מותאמת אישית גרמה למהפכה בטיפול בסרטן, גישה אישית דומה צריכה להינקט בבחירת טיפול TKI מתאים לכל מטופל, בהתאם להערכת הסיכון של תופעות לוואי לטיפול.
בהסתמך על הנחיות NCCN, הוא ציין כי אין בהם הנחיות לניהול הסיכון של בעיות קרדיו וסקולאריות של חולי .CMLד"ר מוסלחי הדגיש את הצורך והחשיבות של שיתוף פעולה הדוק יותר בין המטולוגים לקרדיולוגים בניהול וניטור חולי CML המטופלים ב- TKI שיכולים לגרום לבעיות לב וכלי דם. הוא הזכיר את הפלטפורמה cardioOnc.org, אשר תספק מסד נתונים של תרופות לסרטן והסיכון שלהן לרעילות לב וכלי דם.
לסיכום, ד"ר מוסלחי הדגיש כי CML כמחלה כרונית מדגימה את כל היתרונות והחסרונות של טיפול כרוני במחלה לטווח ארוך. בשל שכיחות גבוהה יחסית של אירועים קרדיווסקולאריים בטיפול CMLב- TKI, הוא ממליץ שניטור בעיות לב וכלי דם צריך להיות משולב בטיפול בחולי CML גם בפרקטיקה וגם בניסויים קליניים.
ד"ר ראבי בהטיה הציג על גישות חדשות לטיפול ב- CML עם דגש על חיסול תאי גזע לויקמיים מתמשכים. הצורך בגישות חדשות לטיפולים ב- CML נובע ממגבלות של טיפולי TKI קיימים (חוסר סובלנות, התנגדות, הישנות והתקדמות וכן התמדה בתאי גזע של לוקמיה). במונחים של התנגדות, ההתנגדות העיקרית (בזמן האבחון) היא נדירה למדי ב- CML, ועשויים להיות קשורים לאופן שבו תרופות עוברות חילוף חומרים ומועברות בגוף. ההתנגדות הנרכשת (שפותחה במהלך הטיפול) עשויה להופיע כאשר מוטציות של "האתר המחייב" של TKI (מוטציות תחום קינאז) מתרחשות, כמו גם כאשר מופיעים מסלולים עצמאיים של קינאז, למשל. נתיבי איתות חלופיים אשר עשויים להיות משותף עם תאי גזע מתמשך.
הרציונל למקד תאי גזע לויקמיים שיוריים עם תרופות חדשות הוא להגביר את האפשרות העתידית של הפסקת הטיפול ולהימנע מטיפול ארוך טווח, הפחתת הסיכון לאי-ציות ותופעות לוואי לטווח ארוך וכן טרטוגניות (למשל במקרה של הריונות) וכן את הנטל הכספי לחולים משפחות.
תאי גזע לוקמיים קבועים מייצגים בדרך כלל מיעוט באבחון, אך הופכים לאוכלוסייה השלטת במהלך הטיפול. יש להם פרופיל ביולוגי מובהק אשר ניתן לטפל על ידי טיפולים חדשניים אשר נחקרים כיום במעבדה ניסויים קליניים. לדוגמה, השילוב של Nilotinib לבין מעכבי JAK2 Ruxolitinib נבדק כעת. ניסוי שלב II מוסיף Ruxolitinib לטיפול ב- TKI לאחר כשל בטיפול ב- TKI. פיוגליטזון (הידוע גם כתרופה לסוכרת) נבדק גם בשילוב עם Imatinib בחולים עם רמת תגובה בין MMR ו- MR4 במחקר ACTIM בצרפת וכן במחקר PIO2STOP. המחקר CHOICES משלב Imatinib עם Hydroxychloroquine לחסל תאים צעד.
ד"ר Bhatia שיתף כמה "לקחים" למחקרים עתידיים שעשויים להיות המטרה של חיסול תאי גזע CAL שיורית: גיוס חולים עבור מחקרים אלה הוא קשה, ולכן לחשוב על הסיבות מדוע החולים יצטרפו ללימודים צריך להיות נחשב היטב. ביקורים והליכים הקשורים ללימודים הם מניע לחולים להצטרף לניסויים אלו, בהתחשב ברמת הנוחות הגבוהה של טיפול ב- CML כיום. סוכנים נוספים חייבים להיות נסבלים היטב. עדיף לתכנן מחקרים אלו בקשר למטרה של הפסקת הטיפול ב- TKI, או כאשר ההגדרה של הפסקת הטיפול ב- TKI נכשלה, על מנת להניע את המטופלים לעבור למחקרים אלו. אקראיזציה לזרוע TKI לבדה יהיה עדיף.
לקריאת הסיכום המלא בקובץ PDF לחץ כאן….
ASH 2017- הפסקת טיפול לחולי CML שלא במסגרת ניסויים קליניים
שרף גיורא ויאן גייסלר- עמותת הגג של CML העולמית
כמו בשנים קודמות, הפסקת הטיפול במעכבי טירוזין קינאז (TKIs) היה נושא שנדון רבות ובהרחבה בכנס ה- ASH השנה. נתונים חדשים על ניסויים כמו EURO-SKI, DASFREE ואחרים מדגישים את ממצאי הניסויים הקודמים כמו ה- STIM ומגבירים את הוודאות לגבי בטיחות הפסקת הטיפול בסביבה מבוקרת, עם ניטור ומעקב איכותיים ומבוקרים היטב. עדיין קיימת עדיין אי-ודאות לגבי גורמים שעשויים לחזות האם המטופל יוכל להפסיק את הטיפול בהצלחה או לחוות הישנות של המחלה המוליכה לטיפול חוזר. אין עדיין בהירות לגבי המנגנונים הביולוגיים, מדוע חלק מהחולים יכולים להפסיק טיפול בהצלחה בעוד שאחרים אינם מסוגלים.
ניסויים גדולים מתמשכים כמו EURO-SKI יספקו הרבה תשובות, אבל בגלל שיש הרבה ביקוש מצד חולים להפסקת הטיפול בעוד שיש רק מספר קטן של ניסויים שעדיין מגייסים, הפסקת הטיפול מתרחשת כיום ברובה מחוץ למסגרת של ניסויים קליניים על ידי הרופאים המטפלים עם המטופלים. כפי שהוכח בנתונים שהוצגו בכנס ASCO ביוני 2017, על הפסקת טיפול בחולי CML בארה"ב, הדבר עלול להוביל גם לפרקטיקה קלינית גרועה כאשר הדרישות והסיכונים הפוטנציאליים לא נלקחים ברצינות. כדי לספק יותר ודאות על הדרישות, אנו מתחילים לראות המלצות שונות על הדרך הנכונה והבטוחה להפסקת טיפול, אבל הם מבוססים על נתונים מניסויים מוקדמים שהחלו לפני יותר מ- 10 שנים.
ניסינו לסכם עבורכם את מה שההמלצות המעודכנות כוללות.
יורו-סקי: ככל שהתגובה המולקולארית העמוקה (MR4) ארוכה יותר, כך הסיכוי להפוגה ללא צורך לחידוש טיפול גבוה יותר.
סוזאן סוסל מבית החולים מנהיים בגרמניה הציגה נתונים ממחקר ה- EURO-SKI,אותו היא מרכזת. מחקר זה הוא המחקר הגדול ביותר על הפסקת טיפול שנערך אי פעם והוא גייס 868 מטופלים שהפסיקו טיפול TKI בתגובה מולקולארית עמוקה של לפחות MR4.
במסגרת כל המחקרים של הפסקת טיפול שהתקיימו עד היום בכל העולם, יותר מ -2500 מטופלים הפסיקו את הטיפול ב- .TKI רמיסיה ללא טיפול (TFR), ניתנת להשגה עבור 40-55% מהחולים לאחר שהם הפסיקו את הטיפול בתגובה מולקולארית עמוקה (לפחות MR4, BCR-ABL מתחת ל -0.01%) לאחר מספר שנים של טיפול TKI. אצל כ- 9 מתוך 10 חולים שלא הצליחו ומאבדים את התגובה המולקולארית של MMR (מעל % 0.1), ונאלצים לחדש את הטיפול, זה קורה בתוך 6 חודשים לאחר הפסקת הטיפול. הניסויים הנוכחיים מנסים לזהות גורמים פרוגנוסטיים שיאפשרו לחזות את הסבירות שחולה בודד יישאר במצב של רמיסיה לאחר הפסקת הטיפול.
פרופ' סוסל הציגה את הניתוח העדכני ביותר לנתוני ה- EURO-SKI. קריטריוני ההכללה במחקר אקדמי עצמאי זה, החולים היו צריכים להיות בטיפול של TKI מכל סוג שהוא במשך 3 שנים לפחות ולהיות בתגובה מולקולארית עמוקה (MR4) למשך שנה לפחות. החולים היו צריכים לחדש את הטיפול אם ה- PCR שלהם עלה מעל MMR) BCR-ABL 0.1%). 868 חולים גויסו. 47% מהחולים נשארו במצב של רמיסיה ללא טיפול לאחר 36 חודשים מהפסקת הטיפול. למרות ש -9 מתוך 10 חידושי טיפול התרחשו במהלך ששת החודשים הראשונים לאחר הפסקת הטיפול, היו חולים שנאלצו לחדש טיפול גם אחרי ששת החודשים הראשונים והיו איבודי תגובה גם 36 חודשים לאחר הפסקת הטיפול. להבדיל מניסוי ה- STIM הצרפתי הראשון של דר מהון, שם הוצג קו אופקי ישר ללא איבודי תגובה אחרי כ- 20 חודשים, ביורו-סקי נראה שאיבודי תגובה יכולים לקרות גם הרבה זמן אחרי הפסקת הטיפול. בדיון, רופא סקנדינבי אחד אפילו הזכיר הישנות מאוחרת של אחד מחוליו שהפסיק טיפול אחרי יותר מ- 5 שנים. משמעות הדבר היא כי ניטור ובדיקות PCR של חולים שמפסיקים טיפול יידרש לכל אורך חיי המטופל.
המודל הפרוגנוסטי של היורו סקי ישים עד כה על 448 מטופלים בלבד מתוך ה- 868 שגויסו לניסוי. קבוצת הסיכון בזמן האבחון (למשל ניקוד SOKAL), סוג ה- TKI בשימוש, עומק התגובה המולקולארית מתחת ל- MR4 לא השפיע על שיעור ההצלחה. היסטוריה מוקדמת של המטופל של תגובה תת-אופטימלית או עמידות לטיפול ב- TKI הפחיתה את ההסתברות להצלחת הפסקת הטיפול והשגת רמיסיה ללא טיפול. חשוב יותר, משך הטיפול ומשך התגובה המולקולארית העמוקה לפני הפסקת הטיפול, השפיעו על שיעור ההצלחה: ככל שהטיפול ב- TKI ומשך התגובה העמוקה- MR4ארוכים יותר, כך ההסתברות להישאר ללא טיפול תהיה גבוהה יותר. מעניין לציין כי ההסתברות להישאר ברמיסיה לאחר הפסקת הטיפול עלתה ב -3% לכל שנה בה החולה היה בהפוגה של MR4, בעוד שהשפעה של משך שנות הטיפול ב- TKI היה נמוך בהרבה (1% בשנה). התוצאות הטובות ביותר להפסקת טיפול באימטיניב הושגו אם למטופלים היו לפחות 5.8 שנים של טיפול באימטיניב ולפחות 3.1 שנים של תגובה מולקולארית עמוקה – נתונים דומים עבור דסטיניב ונילוטיניב טרם נבדקו. בנוסף, ההיסטוריה הקודמת של המטופל של תגובה תת-אופטימלית או עמידות לטיפול ב- TKI הפחיתה גם את הסיכוי להשגת הפוגה ללא טיפול מוצלחת וארוכה.
הפסקת טיפול אחרי ספריסל- Dasatinib: המחקר DASFREE
דר' ניל שאה מסאן פרנסיסקו, הציג את נתוני המעקב של שנה אחת מניסוי ה- DASFREE, כאשר הפסקת הטיפול בספריסל נעשתה בתגובה מולקולרית עמוקה MR4.5 (BCR-ABL נמוך מ-0.0032% , כך שבניסוי זה קריטריון ההפסקה מחמיר יותר מזה שביורו סקי שהיה 4MR). החולים היו צריכים להיות על טיפול בדסטיניב לפחות שנתיים (שנה פחות מאשר ביורו סקי) ותגובה מולקולארית עמוקה לפחות שנה אחת (כמו ביורו סקי). המטופלים גם היו צריכים לחזור מחדש לטיפול כשאיבדו את ה- MMR.
44% מהחולים בניסוי קיבלו את הדסטיניב כטיפול קו ראשון, כל החולים האחרים קיבלו אותו לאחר שפיתחו עמידות או אי סבילות לטיפול TKI קודם. שיעור ה- TFR (רמיסיה ללא טיפול) אחרי שנה עמד על 48% – 54% בקרב מטופלי הקו הראשון ו -43% עבור החולים שהיו על דסטיניב כטיפול שני או יותר. חציון משך הפסקת הטיפול לאובדן MMR היה 4 חודשים (טווח בין 1-16 חודשים). כל החולים שנאלצו להתחיל מחדש את הטיפול חזרו במהירות ל- MMR לאחר טיפול חוזר (חציון הזמן להחזרת MMR היה 1.9 חודשים), 90% חזרו לפחות ל- MR4.5. במונחים של גורמים פרוגנוסטיים, לגיל, מין, משך ה- TKI הקודם, קו טיפול קודם, קבוצת סיכון לפי סוקל לא היתה כל השפעה על ההצלחה של הפסקת הטיפול. 9.5% מהחולים הראו תסמיני גמילה של כאבי עצמות ושרירים, ורוב האירועים נפתרו ללא התערבות רפואית.
ד"ר שאה סיכם כי המחקר DASFREE תומך בכדאיות של הפסקת הטיפול בתגובה מולקולארית עמוקה בטיפול בדסטיניב קו ראשון.
נתוני מעקב של 8 שנים של מחקר ה- TWISTER STOP מאוסטרליה: בחולים עם רמיסיה ללא טיפול ארוך טווח, מספר תאי CML שיורים עשוי לקטון עוד יותר
ד"ר טים יוז מאוסטרליה הציג את נתוני המעקב ארוכי הטווח של מחקר TWISTER, אשר גייס 40 מטופלים שטופלו בגליבק בשנת 2006. כפי שדווח בשנים קודמות, 42.7% מהחולים נשארו במצב של רמיסיה ללא טיפול חציון של 8.6 שנים (טווח 5.8-10.8 שנים). בפוסטר שהציג דר יוז השנה, הא תאר את הדינמיקה של מחלה שיורית מינימלית (MRD) לאורך זמן ב -6 חולים ב- TFR, תוך שימוש ב- gDNA PCR רגיש מאוד, המסוגל לזהות BCR-ABL עד לרמה של MR6. בחולים אלו, רמת המחלה השיורית ירדה מחציון של MR5.3 לחציון של MR6 בשלוש השנים האחרונות, כך שהייתה ירידה בתאי לוקמיה גם לאחר הפסקת הטיפול באימטיניב. החוקרים משערים כי זה יכול להיות בגלל מוות של תאי CML בגלל חוסר היכולת של תאי אלו לחדש את עצמם.
תוצאות ביניים של ניסוי קנדי בהפסקת טיפול שנייה בחולים שנכשלו בהפסקה ראשונה אחרי אימטיניב- בעזרת דסטיניב.
ניסוי נוסף מעניין של TFR מקנדה. 118 חולים אשר נטלו את אימטיניב במשך 3 שנים לפחות והיו MR4.5 למשך שנתיים לפחות, הפסיקו את הטיפול. החולים שאיבדו את הרמיסיה המולקולרית והתחילו טיפול הועברו לדסטיניב. אחרי שהשיגו תגובה מולקולרית טובה, הם הפסיקו את הדסטיניב. מטרת ניסוי זה היא לבחון האם טיפול בדסטיניב והשגת תגובה מולקולארית עמוקה יותר, יכולים לאפשר הפסקת טיפול שנייה למטופלים שנכשלו אחרי הפסקת טיפול באימטיניב.
שיעור ה- TFR תוך שימוש ב- MMR כקריטריון לחידוש טיפול היה 66.6% אחרי 12 חודשים מהפסקת הטיפול באימטיניב. מתוך 41 מטופלים שאיבדו תגובה מולקולארית, כיום 40 נמצאים בטיפול על דסטיניב.
יש קורלציה חזקה מאד בין הצלחת הפסקת הטיפול באימטיניב עם משך הזמן שהמטופל טופל באימטיניב לפני הפסקת הטיפול, וגם למשך הזמן שהמטופל היה ברמיסיה מולקולארית עמוקה של MR4 או MR4.5. בקבוצת החולים שהיו על אימטיניב יותר מ- 8 שנים היה שיעור הצלחת הפסקה של 79.5% לעומת 27.9% אצל החולים שהיו פחות מ- 8 שנים. בקבוצה עם יותר מ -7.8 שנים רמיסיה מולקולארית עמוקה היה שיעור הצלחה של 80.0% לעומת 39.7% באלו שהיו זמן קצר יותר ברמיסיה עמוקה.
מתוך 40 מטופלים שטופלו בדסטיניב, 7 השיגו MR4.5 או תגובה עמוקה יותר תוך 12 חודשים והפסיקו טיפול. מתוכם שני חולים איבדו MMR. חמשת החולים הנותרים נמצאים במעקב צמוד ללא איבוד התגובה המולקולארית.
החוקרים מסכמים שניתן לטפל בבטחה בחולי CML אשר מאבדים תגובה מולקולארית לאחר הפסקת טיפול של אימטיניב. 100% מחולים אלו שהתחילו דסטיניב השיגו MMR תוך 3 חודשים. משך זמן ממושך של טיפול באימטיניב, או משך זמן של התגובה המולקולארית העמוקה MR4 / MR4.5 על אימטיניב, מגביר את הצלחת ה- TFR ב 11-17% בשנה. נדרש מעקב ארוך יותר והגדלת מספר החולים בניסוי להסיק מסקנות סופיות.
המלצות על עצירת TKIs מחוץ לניסוי קליני
קהילת מומחי ה- CML העולמית עדיין מתלבטת בדרישות ובקריטריונים האישיים של המטופל להפסקת הטיפול ב- CML באופן בטוח מחוץ לניסויים הקליניים.
ההנחיה האמריקאית לטיפול ב- CML של ה- NCCN, שפורסמה בתחילת 2017, כוללת גם הנחיות על הפסקת הטיפול, אך היא בעייתית כי ברוב ארה"ב לא קיימת תקינה וסטנדרט בינלאומי של בדיקות ה- PCR. עדכון של המלצות ה- ELN האירופי עדיין לא הסתיים וטרם פורסם. השמועות אומרות שיש חילוקי דעות בין כ- 30 המומחים שמעורבים בכתיבת המלצות אלו ולכן הפרסום מתעכב. הקווים המנחים האירופאים של ESMO CML 2017, המספקים גם המלצות להפסקת הטיפול, פורסמו בקיץ 2017. בנוסף, בכנס ה- ASH 2017 נמסר לנו על ידי חברי קבוצת המומחים ל- מCML בצרפת, FILMC, שהם עומדים לפקסם המלצות משלהם להפסקת טיפול בפרקטיקה מחוץ לניסויים קליניים.
יש הסכמה בין כל ההמלצות כי אפשר לשקול הפסקת הטיפול במטופלים בודדים אם ניתן להבטיח ניטור תקין, איכותי ומתוקנן. בנוסף, ישנן דרישות מהמוסד המטפל ומהמעבדה המולקולארית שיבטיחו פיקוח בטוח ומעקב קבוע אחרי המטופל, תמלילי BCR-ABL שניתנים לכימות, זמינות של PCR איכותי עם רגישות של 4.5 לוג לפחות, ואת היכולת של זמן החזרה מהיר של תוצאות ה- PCR. נדרש גם ליידע את החולה על הסיכון של הפסקת טיפול ועל הצורך בבדיקות PCR תכופות. עם זאת, ההמלצות נבדלות במונחים של מספר שנים של טיפול ב-TKI , עומק התגובה המולקולארית (MR4 או MR4.5) ומספר השנים בתגובה מולקולארית עמוקה (2-3 שנים) הנדרשות כדי להפסיק את הטיפול בבטחה.
כדי להבין טוב יותר את ההמלצות השונות הקיימות היום עוד לפני פרסומן של המלצות ה- ELN, הכנו טבלה מסכמת עם סקירה כללית של ההמלצות השונות והדרישות המינימאליות, כאשר שוקלים הפסקת טיפול ב- CML:
לקריאת הטבלה והמאמר בקובץ PDF לחץ כאן….
פגישת קבוצה למידע ותמיכה לחולי CML
פגישה מספר 149, ינואר 2018
קבוצת המידע והתמיכה הארצית לחולי CML (לוקימיה מילואידית כרונית), נפגשת אחת לחודש, בדרך כלל בכל יום רביעי הראשון בחודש בשעות 16.00-18.00 בבית החולים לניאדו בנתניה. לעיתים יש שינויים בימי הפגישה ואלו מפורסמים בחלון החדשות באתר האינטרנט של העמותה www.cml.org.il .
המפגש הבא של העמותה יתקיים ביום רביעי 21.2.2018 בשעה 16.00 בבית החולים שיבא. המפגש של חודש פברואר יוקדש לסיור במעבדות ההמטולוגיות, להבנת ההבדלים בין סוגי הבדיקות השונות שאנחנו עושים כמו בדיקות ציטוגנטיקה, FISH, PCR ובדיקת מוטציות. יהיו הרצאות שיסבירו את חשיבות המעקב והניטור של חולי CML ביום יום וגם כששוקלים הפסקת טיפול. המפגש יתקיים מהשעה 16.00 עד 20.00, באודיטוריום של המחלות האוטואימוניות. מצ"ב תוכנית של המפגש. הוראות הגעה לאודיטוריום :
אפשרות ראשונה להגיע למרכז למחלות אוטואימוניות:
מקניון הצומת (קומה רביעית בחניון המרכזי) מגיעים לפרוזדור הנושק לחנות ולמרכז שירות סלקום, ממשיכים ישר בפרוזדור עד הסוף O-BOX בשם (מרכז למדעי המוח) והמרכז נמצא בצד שמאל.
אפשרות שניה להגיע למרכז למחלות אוטואימוניות:
מהכניסה לבניין האישפוז בסמוך למרפאה אורטופדית עומדת עגלת קפה. בפרוזדור זה, בסמוך לעגלה יש מעלית מצד שמאל. יש לעלות לקומה אחת, לצאת מהמעלית ושמאלה עד סוף הפרוזדור.
במפגש חודש ינואר האחרון התארח אצלנו לראשונה דר' יקיר משה (יקיר שם פרטי), מבית החולים איכילוב, שסיכם עבורנו את החדשות על CML שהוצגו בכנס ה-ASH האחרון שהתקיים בתחילת דצמבר באטלנטה ארה"ב. זהו הכנס ההמטולוגי החשוב ביותר כל שנה בו מוצגים הנתונים מהמחקרים האחרונים.
הסקירה של יקיר התמקדה בשני נושאים עיקריים. הפסקת טיפול ב- CML וגישות ניסיוניות חדשות לטיפול. מכיוון שגיורא הכין סיכום מפורט על הפסקת טיפול ממה שהוצג בכנס, שמצורף לסיכום זה, נתמקד בנושא השני ונסקור רק בקצרה כאן את נושא הפסקת טיפול. הניסוי הראשון של הפסקת טיפול היה של דר פרנסואה מהון מצרפת, ניסוי ה- STIM שכלל 100 משתתפים ודווח לראשונה בשנת 2010. יותר מ- 2500 חולים ברחבי העולם השתתפו בניסויים שונים להפסקת טיפול עד היום. במטא-אנליזה שסיכמה 15 מחקרים כאלו שכללו 509 חולים, נמצא כי אחרי שנתיים % 51 מהחולים חזרו לטיפול עקב הישנות מולקולארית. שני הגורמים שנמצאו כסמנים לסיכוי הצלחה בהפסקת טיפול היו משך הטיפול באימטיניב ומשך התגובה המולקולארית העמוקה לפני ההפסקה. מרבית החזרה לטיפול ארעה תוך 6 חודשים מהפסקת הטיפול. גם בניסוי הגדול ביותר שנערך עד היום, היורו-סקי שגייס 821 משתתפים, אחרי 3 שנים שיעור החולים ששמרו על תגובה מולקולארית עמד על % 47. כמעט כל החולים שחזרו לטיפול השיגו תגובה מולקולארית עמוקה דומה למה שהיה להם לפני הפסקת הטיפול. חשוב להדגיש כי בניסוי היורו-סקי רואים הישנות מולקולארית גם אחרי יותר משלוש שנים מהפסקת הטיפול, ולכן חשוב מאד להמשיך לעשות בדיקות ומעקב כל השנים אחרי ההפסקה.
כאן עבר יקיר לדבר על שני ניסויים מעניינים של הורדת מינון. האחד היה מחקר תצפיתני של דר דלפין ריאה מצרפת על הורדת מינון לחולים מטופלים בטסיגנה, והשני מחקר הדסטיני מאנגליה שבו הורידו מינון בכמה סוגים של תרופות למשך שנה כשלב ביניים לפני הפסקת טיפול. הנתונים על הניסוי של דלפין מסוכמים בסיכום השלישי של גיורא אז אין טעם לחזור עליהם כאן. במחקר הדסטיני מאנגליה שבו השתתפו 174 חולים % 7 מהם איבדו תגובה מולקולארית אחרי הורדת המינון בחצי וכולם חזרו לתגובה שהייתה להם לאחר החזרת המינון המלא.
כאן עבר יקיר להסביר בפרוטרוט מהם תאי אב לוקמיים. יקיר הסביר על מנגנונים שונים היכולים לאפשר אולי ניסיון השמדה של שארית תאי האב הלוקמיים שאם יצליח יקרב אותנו למצב ריפוי של המחלה. כמובן שזה לא פשוט וגם הטיפולים השונים שמפתחים להגיע לתאי האב יכולים בעצמם להיות רעילים, כך שיש הרבה ניסיונות ותקווה לעתיד.
תודה ליקיר על הרצאה מעניינת מאד ועל הסבלנות לענות לשאלות הרבות.
חדשות מהעמותה
ראובן הראל– אנחנו נפרדים בצער מחברינו הוותיק ראובן הראל שנפטר לאחרונה שלא כתוצאה מה- CML. כולנו שולחים חיבוקים ותמיכה לאשתו יונה, חברת וועד העמותה. שלא תדעי עוד צער.
כנס שנתי 2018– מסתמן שהכנס השנתי שלנו יתקיים בתאריכים חמישי עד מוצ"ש
4-6 לאוקטובר 2018. אנא שריינו את התאריכים. הודעה על המלון ומיקום הכנס תגיע בהמשך.
נשמח לראותכם במפגש הבא
ביום רביעי ,21.2.2018
בבית חולים שיבא
אל תתנו לתקווה לברוח מליבכם
לפרטים ושאלות אנא צרו קשר עם:
שרף גיורא, רחוב אהוד מנור 6 , נתניה 42248
טלפון: 09-8348498
נייד: 050-7516690
דואר אלקטרוני: [email protected]
קבוצת המידע והתמיכה הארצית לחולי CML (לוקימיה מילואידית כרונית), נפגשת אחת לחודש, בדרך כלל בכל יום רביעי הראשון בחודש בשעות 16.00-18.00 בבית החולים לניאדו בנתניה. לעיתים יש שינויים בימי הפגישה ואלו מפורסמים בחלון החדשות באתר האינטרנט של העמותה www.cml.org.il .
המפגש הבא של העמותה יתקיים ביום רביעי 3.1.2018 בשעה 16.00 בבית הספר לאחיות בבית החולים לניאדו. במפגש נארח את דר משה יקיר שאחראי היום על תחום ה- CML בבית חולים איכילוב, שיסכם עבורינו את החדשות החמות על המחלה כפי שהוצגו בכנס ההמטולוגים החשוב ביותר כל שנה- ה-ASH שהתקיים בדצמבר באטלנטה בארה"ב. נשמע על הפסקת טיפול, תרופות חדשות שבדרך, גנריקה לתרופות ב- CML, תופעות לוואי ואיך מטפלים בהן ועוד.
במפגש חודש דצמבר האחרון התארחה אצלנו ליאורה קום שהנחתה סדנה של "הצחוק יפה לבריאות". ליאורה, מרצה ומנחת צחוק ושמחה כדרך חיים, נתנה הרצאה על חשיבות הצחוק ויתרונותיו הבריאותיים. סיפקה דוגמאות מעבודתה בבתי חולים עם חולים אונקולוגים העומדים טוב יותר בטיפולים ובכאבים דרך עבודת הצחוק.
ליאורה סיפרה שילדים קטנים צוחקים מאות פעמים ביום לעומת מבוגרים שצוחקים עשרות פעמים בלבד ואין להם את שמחת החיים של הילדים.
לאחר ההרצאה כולנו השתתפנו בתרגילי צחוק ותנועה ויצאנו עם חיוך גדול ושמחת חיים כמו של הילדים הקטנים.
תודה לליאורה על סדנה מרתקת ומשמחת.
חדשות מהעמותה
ילדי CML חדשים– אנו מברכים מעומק לב את מאיה, יעל ולובה שילדו בשעה טובה בחודשים האחרונים תינוקות בריאים ומתוקים. זו ההוכחה שכל חולת CML יכולה להרות וללדת בביטחה אבל נדרש ליווי של רופא\ה מיקצועי שמבין בתחום.
נשמח לראותכם במפגש הבא
ביום רביעי ,3.1.2018
אל תתנו לתקווה לברוח מליבכם
לפרטים ושאלות אנא צרו קשר עם:
שרף גיורא, רחוב אהוד מנור 6 , נתניה 42248
טלפון: 09-8348498
נייד: 050-7516690
דואר אלקטרוני: [email protected]
פגישה מספר 147, נובמבר 2017
קבוצת המידע והתמיכה הארצית לחולי CML (לוקימיה מילואידית כרונית), נפגשת אחת לחודש, בדרך כלל בכל יום רביעי הראשון בחודש בשעות 16.00-18.00 בבית החולים לניאדו בנתניה. לעיתים יש שינויים בימי הפגישה ואלו מפורסמים בחלון החדשות באתר האינטרנט של העמותה www.cml.org.il .
המפגש הבא של העמותה יתקיים ביום שלישי 5.12.2017 (שימו לב- יום שלישי) בשעה 16.00 בבית הספר לאחיות בבית החולים לניאדו. במפגש נארח את ליאורה קום שתעביר לנו סדנא מהנה- "הצחוק יפה לבריאות". מחוות דעת שקיבלנו מחברי העמותה המרצה והסדנא ברמה מאד גבוהה ומקצועית ובטח טוב לעשות משהו חטובת הבריאות שלנו.
במפגש חודש נובמבר האחרון התארחה אצלנו הגב" איזבל מייקל מטפלת ומלווה חולים אונקולוגים בהתנדבות בבית חולים איכילוב בתל אביב. הגב' איזבל ילידת צרפת, הייתה בעברה מעצבת אופנה מצליחה בעלת מספר חנויות. היא גרושה+3 ילדים.
לפני 12 שנים חלתה בעצמה בסרטן השד. היא מכרה את עסקיה והחלה בטיפולים וגם ניתוחים להוצאת הרחם והשחלות. השנה הראשונה הייתה לה קשה מאוד. בעודה מאושפזת במהלך הטיפול השני, מתנדבת שעשתה לה טיפול פנים הציעה לה טיפול בדמיון מודרך. בעקבות הטיפול היא הרגישה הרבה יותר טוב במהלך הטיפולים הכימיים.
משסיימה את הטיפולים והחלימה החליטה לעשות לעצמה. נרשמה למכללת רידמן ולמדה במשך 5 שנים דמיון מודרך, רייקי, ריברסינג,מדיטציות ועוד. איזבל החליטה לעשות שינוי בחייה ולהקדיש את זמנה לטיפול בחולי סרטן. פעמיים בשבוע היא נמצאת בבית חולים, עוזרת לחולים להתמודד עם מצבם הקשה. כמו כן היא מלמדת ומרצה על התמודדות עם מחלות ומודעות עצמית שדרכה אפשר להטיב עם החולים. לדעתה כל מפגש עם מחלה, טראומה, משבר אחד מדרכי הטיפול בהם היא הנשימה.
בעזרת נשימות עמוקות אנו מתחברים לכאן ולעכשיו. הנשימה עוברת בכל הגוף ועוזרת להרפות את המתח והכעסים ואף עוזרת לשחרר פחדים. הנשימה עוזרת לנו להטעין מחדש את הגוף ולהזרים אנרגיה חדשה.
במהלך הסדנא, בהנחייתה של איזבל כמובן, התנסינו בנשימות עמוקות ומשחררות והיה עלינו להיאנח בקול כשהוצאנו את האוויר. איזבל הסבירה שנשימות עמוקות עוזרות להירדם למי ששנתו נודדת. כשאתה נושם – אתה מתחבר לגוף, מתמקד בו ואז המחשבות נעלמות. זהו בעצם חדר כושר של המוח. כשאנו נושמים עלינו להיות מודעים לנשימה עצמה, לאזורים הכואבים, לחששות ולכעסים. מדיטציית נשימה מביאה אותנו למודעות עצמית ולהבנה של כאן ועכשיו.
תודה לאיזבל על ההרצאה המעניינת והמחזקת. תמיד טוב לקבל כלים נוספים להתמודד עם המחלה והטיפולים.
חדשות מהעמותה
חברים חדשים-
סוניה- אמא של טליה בת 24 מכפר סבא.מטופלת במאיר. אובחנה בזמן שהייתה בהריון וילדה ילד בריא. התחילה טיפול בגליבק עם תופעות לוואי קשות ועברה לספריסל. גם מהסריסל סובלת מאד מתופעות לוואי ומשתמשת הקנביס רפואי להקל עליהן. סוניה מגיעה למפגשים במקום טליה כדי להבין ולעזור ככל יכולה.
תמיר– בן 38 גר ביבנה נשוי עם ילדים. אובחן לפני מספר חודשים והחל טיפול בסריסל. אשתו ביולוגית כך שהיא מבינה במחלה והבדיקות. מטופל אצל דר וולצ'ק בשיבא. אין לו כמעט שום תופעות לוואי לטיפולים וממשיך לעבוד ולתפקד.
טיראן- איש הייטק בסביבות גיל 50. אובחן באוגוסט 2015 לפני 3 שנים. מטופל גם כן בספריסל עם תופעות לוואי של כאבי שרירים ועצמות ועייפות. מחפש להחליף כיוון בחיים ולמצוא עבודה חדשה. מטופל אצל דר עדי שחם בבילינסון.
אנו מקדמים בברכה את כל החברים\ות החדשים ומאחלים להם התמודדות קלה והרבה בריאות.
כנס ה- ASH – בחודש דצמבר יתקיים כנס האש הגדול עם כ-25,000 רופאים המטולוגים מכל העולם כולל לא מעט המטולוגים מהארץ. אני אהיה שם להביא לכם את החדשות שיפורסמו בכנס על המחלה והטיפולים. מעניין במיוחד החדשות על התרופה החדשה שבדרך של חברת נוברטיס ה- ABL001
מחקר חדש בארץ עם תרופת ה- ABL001- לראשונה בישראל נפתח ניסוי בפאזה 3 בתרופה החדשה של נוברטיס ABL001 . הניסוי מיועד לחולי CML בשלב הכרוני שנכשלו או פיתחו אי סבילות לפחות לשתי תרופות מסוג TKI. התרופה עובדת במנגנון שונה מיתר התרופות המאושרות ויכול להיות שלחולה שנכשל בשתי תרופות שווה לשקול הצטרפות לניסוי. הניסוי הוא בין לאומי בעשרות מדינות ומרכזים ויגייס כמה מאות חולים. החולים יחולקו באקראי על ידי המחשב לשתי קבוצות שאחת תקבל את התרופה החדשה והשנייה את תרופת הבוסוטיניב.(יחס חלוקה 2:1 לטובת ABL)
הניסוי נפתח בבתי החולים רמבם ואסף הרופא. מי שמעוניין בפרטים נוספים שיתקשר אלי ואחבר אותו לרופאים שמנהלים את הניסוי.
השתתפות בצערה של חברתנו חנה בר דוד– סיגי, גיורא וועד העמותה משתתפים בכאבה של חנה בר דוד על פטירתה של אמה. שלא תדעי עוד צער.
המצגות והסרטונים של הכנס השנתי הועלו לאתר האינטרנט של העמותה ! כמעט כל ההרצאות המעניינות הועלו לאתר האינטרנט שלנו (www.cml.org.il ) גם עם המצגות וגם עם הסרטונים, כולל על הפסקת טיפול למי ומתי, כולל לחולים וחולות צעירים על הריון ולידה וההרצאה על הקנאביס. מאד ממליץ להיכנס ולראות גם לאלו שהיו בכנס וגם למי שלא היה.
ההרצאות נמצאות תחת כפתור סיכומים ממפגשים ואז יש מתחת לזה כפתור סיכומים וסרטונים מכנסים. תיכנסו אליו ותראו את כל תוכנית הכנס עם המצגות והסרטונים.
הנה לינק ישיר:
נשמח לראותכם במפגש הבא
ביום שלישי ,5.12.2017
אל תתנו לתקווה לברוח מליבכם
לפרטים ושאלות אנא צרו קשר עם:
שרף גיורא, רחוב אהוד מנור 6 , נתניה 42248
טלפון: 09-8348498
נייד: 050-7516690
דואר אלקטרוני: [email protected]
בחודש נובמבר 2017 נפתח
קבוצת המידע והתמיכה הארצית לחולי CML (לוקימיה מילואידית כרונית), נפגשת אחת לחודש, בדרך כלל בכל יום רביעי הראשון בחודש בשעות 16.00-18.00 בבית החולים לניאדו בנתניה. לעיתים יש שינויים בימי הפגישה ואלו מפורסמים בחלון החדשות באתר האינטרנט של העמותה www.cml.org.il .
בחודשים יולי אוגוסט לא יתקיימו מפגשים.
נשוב ונפגש בחודש ספטמבר בכנס השנתי שיתקיים בתאריכים 7-9 בספטמבר במלון אסיינדה במעלות. מי שלא נרשם עדיין ומתכנן להשתתף, מתבקש להרשם בהקדם.
השבוע במפגש העמותה, התארחה הגב' רחל חודדוב, ראש החוג לרפלקסולוגיה במכללת רידמן.
הגב' חודדוב נתנה הרצאה מרתקת ומלהיבה על הקשר בין גוף לנפש ואף הדגימה אבחונים על חלק מחברי העמותה.
בהרצאתה הסבירה על חשיבות הבנת נפש האדם ואבחון אישיותו דרך כפות הרגליים ועל ידי כך להוביל לשינוי אמיתי ממחלה להחלמה.
יש בנו תכונות אופי מולדות ונרכשות כאחד וכאשר אנו חיים בקצב של רדיפה להישגיות, דריכות, עצבנות וקוצר רוח, אנו שוכחים לאזן בין נתינה לקבלה. המוח קולט את המידע ומוריד פקודות לגוף לבצע.
סך כל המסקנות של האדם הם האישיות שלו. כאבים וחרדות של המח עוברים לגוף בצורת מחלות.
ומה מספרים לנו האברים?
הלב – על אהבה שיש לתת ולקבלה
ריאות – על יחסי גומלין
הכליות – על המוסר הפנימי שלנו
שלפוחית השתן – על הפחדים שלנו
הכבד – על כעסים
גב תחתון – על שמחת החיים.
יציבתו של האדם מעידה על מצב רוחו:
אדם שכתפיו שמוטות – נושא עול כבד
אדם קפוץ – הוא אדם שלא סומך על אף אחד ונמצא תמיד במצב של התגוננות.
דם בעל כרס – הוא פגיע מבחינה רגשית.
עלינו להיות מודעים למה שקורה איתנו וסביבנו ולנסות לחיות באיזון ובהרמוניה.
אין ספק ש : "נפש בריאה בגוף בריא"
לבקשת חברי העמותה, מספר הטלפון של הגב' רחל חודדוב הוא 052-2205166
חדשות מהעמותה
כנס CML HORIZONS- אחת לשנה גיורא יחד עם עמיתי לוועד המנהל של עמותת הגג של כל עמותות ה- CML בעולם מקיים כנס שנתי של 3 ימים בהם משתתפים כ- 100 נציגי עמותות CML מכ- 70 מדינות. לכנס מגיעים מיטב המומחים למחלה. הכנס התקיים בתאריכים 26-28 לאוקטובר בפרנקפורט והשתתפו בו גם יאיר ועמי מהעמותה שלנו. אנחנו מעלים לאתר של העמותה הבינלאומית את כל ההרצאות שהיו בכנס, גם ההרצאות הרפואיות וגם ההרצאות הקשורות לפעילות של עמותות חולים. כל מי שמבין אנגלית מוזמן להיכנס לקישור הבא ולצפות בהרצאות. כל הרצאה מצולמת בנפרד עם השקופיות של המרצה. לחברים הצעירים בעמותה אני מאד ממליץ על ההרצאה של פרופ' ג'יין אפרלי מבית החולים המרסמיט בלונדון, שנחשבת למומחית מספר 1 בעולם בתחום של פריון, והריונות לחולי CML.
כמו כן היו הרצאות מרתקות על טיפולים משולבים ב- CML, הפסקת טיפול שנתן הרופא שלי מגרמניה וגם אני הרצאתי על הפרספקטיבה של החולים בכל מה שקשור בהפסקת טיפול, גנריקה לתרופות ועוד הרבה . הנה הקישור לכנס וכל ההרצאות
כנס שנתי- סוף שבוע של מודעות מספר 11 ל- CML- למי שעדיין לא נרשם לכנס המדהים שמחכה לנו בספטמבר, מצ"ב טופס הרשמה. אני עדיין עובד על התוכנית ומקווה לסיים אותה בקרוב. מספר החדרים ששריינו הולך ומתמלא אז אני ממליץ להרשם בהקדם.
מזל טוב ענק- אני מאחל בשם כולנו מזל טוב לתהילה ולבן זוגה עופר על לידת בנם. הנה הוכחה נוספת שאין דבר העומד בפני הרצון וגם חולת CML יכולה להרות וללדת עם טיפול נכון. שיהיה לכם הרבה שמחה ואושר. עופר החמוד כתב לצעירים שכל מי שרוצה ברכה אישית בזמן הברית של בנם, לשלוח לו הודעה פרטית עם השם ושם האם לטלפון- 053-4201115
נשמח לראותכם בכנס השנתי בספטמבר
ביום חמישי ,7.9.2017
אל תתנו לתקווה לברוח מליבכם
לפרטים ושאלות אנא צרו קשר עם:
שרף גיורא, רחוב אהוד מנור 6 , נתניה 42248
טלפון: 09-8348498
נייד: 050-7516690
דואר אלקטרוני: [email protected]